 B .
B . 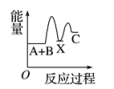 C .
C .  D .
D . 
A | B | C | D | |
强电解质 | Fe | NaCl | CaCO3 | HNO3 |
弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
非电解质 | C12H22O11(蔗糖) | BaSO4 | C2H5OH | H2O |

①写出表示甲烷燃烧热的热化学方程式:。
②CO的燃烧热△H=kJ·mol-1。

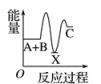
①第一步反应的热化学方程式为。
②第二步反应的△H0(填“>”、“<”或“=”)。
③从图象分析决定生产尿素的总反应的反应速率的步骤是第步反应。
I:
II:
III:
条件 | 保持温度为 | ||||||
时间 | 0 | 5min | 10min | 15min | 20min | 25min | 30min |
| 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
| 0 | 0.3 | 0.50 | 0.65 | 0.75 | 0.80 | 0.80 |
①内,以
表示的该反应速率
,最终达平衡时
的转化率
,该温度
℃下的平衡常数
。
②保持温度℃不变,向该
密闭容器中加入该四种反应混合物各
, 该时刻,正、逆反应速率的大小关系为:
(填“>”“<”或“=”)。
Ⅰ.某实验小组欲通过用酸性和
(草酸)反应测定单位时间内生成
的体积,探究影响反应速率的因素。设计的实验方案如下(
溶液已酸化),实验装置如图甲所示:

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.01 mol·L | 30 mL 0.01 mol·L |
② | 20 mL 0.01 mol·L | 30 mL 0.01 mol·L |
Ⅱ.溶液中存在平衡:(橙色)
(黄色)
。该溶液具有强氧化性。其还原产物
在水溶液中呈绿色或蓝绿色。用溶液进行下列实验:

向
①电离平衡将(填“向电离方向”、“向生成醋酸分子方向”或“不”)移动;
②醋酸的平衡常数Ka将(填“增大”、“减小”或“不变”)
弱酸 | |||
电离平衡常数 (25℃) |
①依据表格中三种酸的电离常数,判断三种酸酸性强弱的顺序为。
②向NaCN溶液中通入CO2气体,反应的化学方程式为。