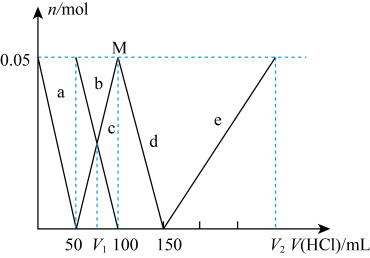
选项 | A | B | C | D |
实验 |
|
|
| 石蕊溶液滴入氯水中 |
现象 | 产生白色沉淀,最终变为红褐色 | 产生淡黄色沉淀 | 沉淀由白色逐渐变为黄色 | 溶液变红,随后迅速褪色 |
已知常温下亚硫酸的电离平衡常数碳酸的电离平衡常数

| 气体 | 液体 | 固体粉末 |
A | CO2 | 饱和Na2CO3溶液 | CaCO3 |
B | Cl2 | FeCl2溶液 | Fe |
C | HCl | Cu(NO3)2溶液 | Cu |
D | NH3 | H2O | Al(OH)3 |
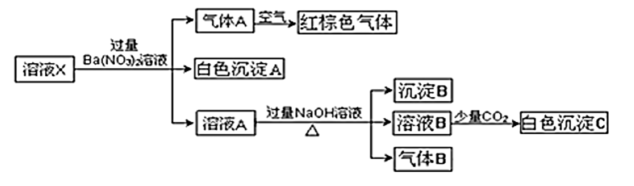
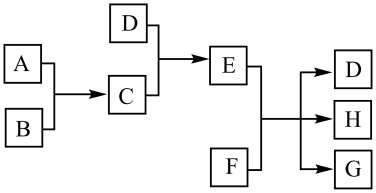
请回答下列问题:
①C的化学式是,D的电子式为。
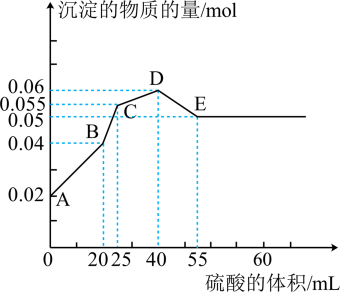
②如何检验E溶液中阳离子?。
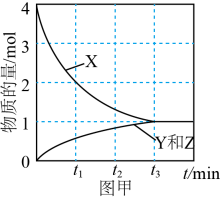

若原电池中生成单质S,其反应的离子方程式为。
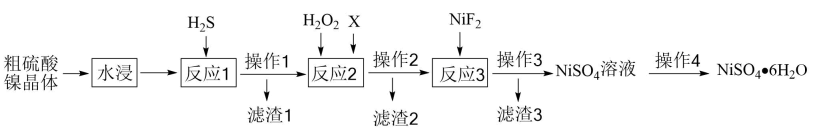
已知:室温下,
查阅资料:
I.氨基钠熔点为
易潮解和氧化;
有强氧化性,不与酸、碱反应;
易溶于水,叠氮酸(HN₃)不稳定,易分解爆炸;+2价锡具有较强的还原性。
II.
回答下列问题:

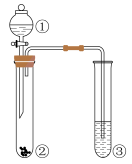
①按气流方向,上述装置合理的连接顺序为(填仪器接口字母)。
②D的作用为。
③C处充分反应后,停止加热,为防止倒吸,需继续进行的操作为;E中溶液的作用是。
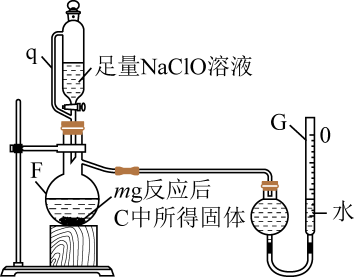
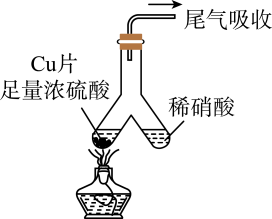
①仪器F中发生反应的离子方程式为。
②管q![]() 作用为。
作用为。
③若G的初始读数为末读数为V₂mL,本实验条件下气体摩尔体积为Vmol·L-1 , 则产品中
的质量分数为。
;
准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗
溶液20.00mL。
如何判断滴定达到了终点?。