周期表中ⅥA族元素及其化合物应用广泛。氧元素常见单质有和
,
在氧气中燃烧的燃烧热为
,
可将
转化为
和
;硫的常见氧化物为
和
,
可做漂白剂;亚硫酰氯(
)为黄色液体,遇水发生水解;Se是不溶于水的半导体材料,可通过
还原
(
)制备;工业上可电解
与
混合溶液制备过二硫酸铵
, 过二硫酸铵与双氧水中都含有过氧键(
)。
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有 | 只有盛 | 氧化性: |
B | 取 | 溶液变为血红色 |
|
C | 乙醇和浓硫酸共热至170℃,将产生的气体通入溴水中 | 溴水褪色 | 乙烯发生了加成反应 |
D | 向 | 出现黄色沉淀 |
|
反应1:
反应2:
恒压下,将起始的混合气体以一定流速通过装有催化剂的反应管,测得出口处
的转化率及
和
的选择性[
]随温度的变化如下图所示。下列说法不正确的是( )
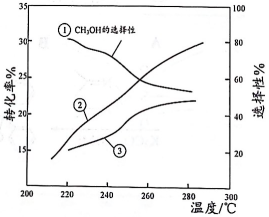

①的二级电离平衡常数
。
②pH为1时“还原”的主要反应的离子方程式为。
已知:在
时开始转化为
,
,
,
。
①一级中和控制pH为2左右,滤渣X的主要成分有。
②二级中和沉淀重金属离子应控制pH范围为。
①计算样品中铜元素的质量分数。(写出计算过程)
②已知纯亚砷酸铜中铜元素的质量分数为23.02%,实际测得样品中铜元素的质量分数有偏差(操作步骤均正确)的原因为。
(已知:;
, 未配平)
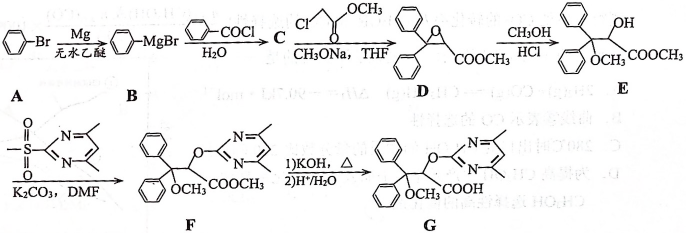
①能与发生显色反应。
②在碱性条件下水解,酸化后所得产物均含有苯环,一种产物只有2种不同化学环境的氢原子,另一种产物分子有4种不同化学环境的氢原子,且个数比为9:2:2:1
 的合成路线。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为。
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是。
①中
键的数目为。
②蚀刻能力恢复的化学方程式为。


图-1 图-2
①为减少胶体形成而影响后续操作,溶液A为(选填“酸性”或“碱性”)蚀刻废液。
②时,铜元素回收率下降的原因为。
向一定质量的酸性蚀刻废液中。
(实验中必须使用的试剂:20%溶液、硝酸银溶液、稀硝酸、蒸馏水)

①“氧化”时在微生物的催化作用下,被氧化为
。该反应的化学方程式为。
②“沉淀”中将“氧化”步骤后剩余的转化为
沉淀,发生反应的离子方程式为。
③若调节pH过大,会降低氨氮去除率,其原因为。
生物硝化反硝化法可将酸性废水中的氨氮转化为氮气,其原理如图-1所示。

图-1
①硝化过程中溶液的pH。(填“升高”或“降低”)。
②每处理含的酸性废水,理论上消耗
的物质的量为。
最近我国科学家开发了如图-2所示电解装置,可将氨氮氧化去除。处理前先调节废水 , 通电后可将其转化为无害气体。

图-2
请结合电极反应式简述其去除氨氮的化学原理。