|
|
|
|
A.壮乡铜鼓 | B.绣球 | C.坭兴陶 | D.壮锦 |
I.切碎植物 | Ⅱ.用乙醇浸出生物碱等 | Ⅲ.去除植物残渣 | Ⅳ.蒸馏浸出液得浸膏 |
|
|
|
|
A.铡刀 | B.广口瓶 | C.分液漏斗 | D.蒸馏装置 |
选项 | 实验目的 | 实验方法或操作 |
A | 配制 | 称取 |
B | 除去粗盐溶液中的 | 向溶液中加入稍过量的 |
C | 探究Cl和I的非金属性强弱 | 向 |
D | 探究 | 向 |
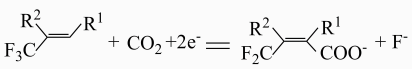 C . 电解过程中有
C . 电解过程中有
反应 | ||
①脱硝反应
的
。
时,为了提高该反应中NO的平衡转化率,理论上可采取的措施是。
A.恒容时增大的压强 B.减小反应容器的容积
C.移去部分 D.选择合适的催化剂
②另一脱硝反应
的
。

当温度低于时,NO的去除率随温度升高而升高,可能原因是;高于
时,NO的去除率随温度升高而降低,结合(1)的信息分析其可能原因是。
I.
Ⅱ.
Ⅲ.
Ⅳ.
V.
上述反应机理中,Ⅱ~V中速率最慢的步骤是。若电路中有电子流过,其中生成
的选择性为95%,电解池阴极生成的
的物质的量为mmol。
Ⅰ.制备
将乙腈、
、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
Ⅱ.纯度分析
取mg产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成溶液。取
溶液,加入指示剂后,再用
标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。

已知:①沸点为81℃,酸性条件下遇水生成
;
②较易被空气氧化;
③EDTA与形成1:1配合物;
④滴定需在弱碱性条件下进行。
回答下列问题:
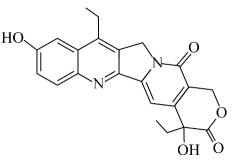
①分子中含环状结构 ②核磁共振氢谱显示2组峰
 )是某些药物分子的重要结构单元。参照上述合成路线,写出以苯为原料制备1,3-二苯基脲的合成路线(无机试剂任选)。
)是某些药物分子的重要结构单元。参照上述合成路线,写出以苯为原料制备1,3-二苯基脲的合成路线(无机试剂任选)。