
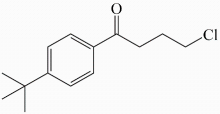
 , 3种原子的原子序数均小于10。关于该有机物的说法正确的是( )
, 3种原子的原子序数均小于10。关于该有机物的说法正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 常温下,用pH计分别测定同浓度的CH3COONH4溶液和NaCl溶液的pH,pH均为7 | 两溶液中水的电离程度相同 |
B | 常温下,用pH计分别测定相同浓度的NaClO溶液和CH3COONa溶液的酸碱性,NaClO溶液pH较大 | 酸性:HClO < CH3COOH |
C | 室温下,向 FeCl3溶液中滴加少量 KI 溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的还原性比 I2的强 |
D | 向10 mL 0.2 mol/L NaOH溶液中滴加2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,生成红褐色沉淀 | 相同温度下Ksp: Mg(OH)2>Fe(OH)3 |
实验 序号 | 30%H2O2溶 | H2O溶液体积/mL | 温度℃ | 0.2mol/LFeCl3溶液/mL | 收集氧气的体积/mL | 反应所需 |
① | 3 | 2 | 20 | 2 | 10 | 175.65 |
② | 5 | 0 | 20 | 2 | 10 | 138.32 |
③ | 5 | 0 | 35 | 2 | 10 | 89.71 |
④ | 5 | 0 | 55 | 2 | 10 | 30.96 |
① 反应i离子方程式为。
② 某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴溶液,产生蓝色沉淀。
③ 另有同学用pH传感器测得的pH-时间图像中各段pH变化如图,加入FeCl3时pH值骤降至a点,是因为配制、保存FeCl3时需加入(填名称)抑制其水解。由图像pH值的变化可证明反应分两步进行,且反应速率反应i(填“>”、“=”或“<”)反应ii。

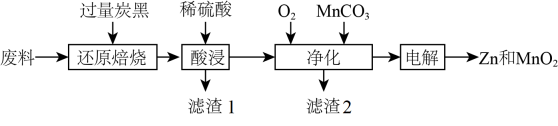
资料a:Mn的金属活动性强于Fe;
Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH
| Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
开始沉淀时 | 8.1 | 6.2 | 1.9 |
完全沉淀时 | 10.1 | 8.2 | 3.2 |
回答下列问题:
I.C2H5OH(g)+H2O(g)2CO(g)+4H2(g)ΔH1=+255.7 kJ·mol-1
II.CO(g)+H2O(g) CO2(g)+H2(g)ΔH2=-41.2 kJ·mol-1
III.C2H5OH(g)+3H2O(g)2CO2(g)+6H2(g)ΔH3

① ΔH3= kJ·mol-1
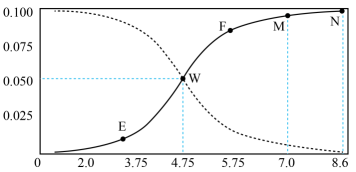
② 在恒容反应炉内测得平衡时,乙醇转化率、H2产率和含碳产物体积分数与反应温度的关系如图所示,则最佳反应温度是,理由是。
③下列能判断反应I在恒容条件下达到平衡状态的是 。

A.混合气体的平均摩尔质量不变
B.单位时间内断开2molO-H键同时断开4molH-H
C.体系的压强不变
D.CO与H2的体积比不变
发生上述反应,平衡时CO2和CO的选择性、乙醇的转化率随温
度的变化曲线如图所示[已知:CO的选择性]
① 表示C2H5OH转化率的曲线是(填标号);
② 573K时,只考虑反应I和反应III,生成氢气的体积分数为(保留2位有效数字);

则催化剂X(填“优于”或“劣于”)催化剂Y,理由是。
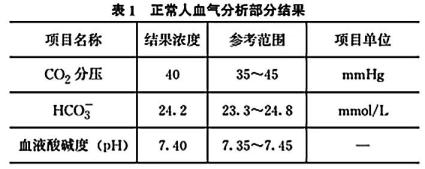
① 预测“酸中毒”时表1“结果浓度”有可能会有哪些变化:。
② 配制某浓缩透析液需要用到的溶质有:0.7mol/LNaCl,0.01mol/LKCl,0.075mol/LCaCl2和0.15mol/LNaHCO3 , 直接混合各溶质会有沉淀(填化学式)和气体(填化学式)生成。
③ 医院透析液分两瓶存放,使用时稀释再混合。其中一瓶为NaHCO3 , 下列说法正确的是。
A. c(Na+)>c(HCO3-)>c(H+)>c(OH-)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
C. c(CO32-)>c(H2CO3)
D. c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)