 B . 倾倒液体
B . 倾倒液体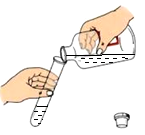 C . 滴加液体
C . 滴加液体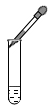 D . 加入块状固体
D . 加入块状固体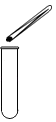
 B .
B .  C .
C .  D .
D . 

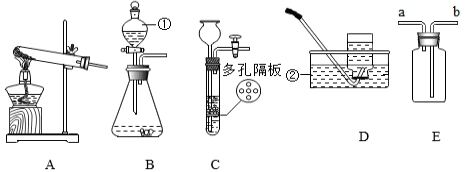
 B . 等质量、等浓度的过氧化氢溶液制取氧气
B . 等质量、等浓度的过氧化氢溶液制取氧气  C . 高温加热氧化铜和碳的混合物
C . 高温加热氧化铜和碳的混合物  D . 一定质量的石灰石中不断加入稀盐酸
D . 一定质量的石灰石中不断加入稀盐酸 
A 电灯发光 B 木炭燃烧 C 食物腐烂 D .

A.反应前后分子的种类一定改变 B.反应前后共有三种氧化物
C.丙物质由8个原子构成 D.反应中甲和丁的分子个数比是
选项 | 实验目的 | 实验方法 |
A | 实验室鉴别食盐水和蔗糖水 | 尝味道 |
B | 区分氧化铜粉末和炭粉 | 观察颜色 |
C | 除去井水中的色素和异味 | 加入活性炭 |
D | 除去氯化亚铁溶液中少量氯化铜 |


农业上用硫酸铜、生石灰加水混合配制常用的杀菌剂波尔多液,但不能用铁制容器配制,原因是(用化学方程式解释)。
【查阅资料】制备硫酸铜的一种方案:Cu+H2O2+H2SO4=CuSO4+2H2O。
【进行实验】将反应物装入烧杯中,观察到如下现象:开始时有少量气泡,后来反应剧烈产生大量气泡,放出热量,溶液呈蓝色,该溶液即为硫酸铜溶液。
【提出疑问】实验中为什么有气体生成?同学们进行了如下探究。
项目四:实验异常现象探究
【查阅资料】制备硫酸铜过程中,H2O2发生了分解反应,生成的气体是
【提出问题】什么因素加快了H2O2分解?
【猜想与假设】
猜想一:生成的CuSO4;
猜想二:温度升高;
猜想三:。

【实验分析】
实验观察到的现象:实验一产生气泡;实验二无明显现象;实验三产生气泡;实验四快速产生气泡,对比实验一和实验二可以得出的结论是。为了验证温度升高能加快H2O2的分解,甲同学的方案是实验二和实验三对比;乙同学的方案是实验一和实验四对比。你认为同学的方案更严谨,理由是。
【实验结论】猜想三正确。
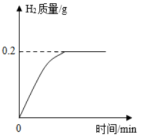
请回答: