 B .
B .  C .
C .  D .
D . 
选项 | 实验操作 | 实验现象 |
A | 将CO还原CuO后的气体通入氯化钙溶液中 | 一段时间后有大量白色沉淀产生 |
B | 用洁净铂丝蘸取某钾盐溶液,在火焰上灼烧 | 火焰的颜色为紫色(透过蓝色钴玻璃观察) |
C | 将一小块钠投入滴有酚酞的水中 | 钠浮在水面上,并熔化成小球、快速游动、嘶嘶作响、溶液变红色 |
D | 点燃氢气后伸入装有氯气的集气瓶中 | 氢气能安静地燃烧,发出苍白色火焰,瓶口上方有白雾 |
①NaClO溶液常用于环境消毒,则NaCl溶液也常用于环境消毒
②Na在空气中燃烧生成Na2O2 , 则Mg在空气中燃烧生成MgO2
③Fe在潮湿空气中生锈生成Fe2O3 , 则Cu在潮湿空气中生锈生成CuO
④Fe可以置换出CuSO4溶液中的铜,则Na也可以置换出CuSO4溶液中的铜
选项 | A | B | C | D |
实验装置或操作 |
|
|
|
|
实验目的 | 证明NaHCO3受热易分解 | 证明CO2能与烧碱溶液反应 | 防止倒吸 | 制备O2 |


①横线上应填写的内容为。
②样品中Na2CO3的纯度为(用含x、y的代数式表示)。

已知:氯化铜容易潮解;石棉绒的作用是为了增大气固反应物的接触面积,使反应充分进行。
请回答下列问题:
ⅰ.经检验装置E中除了含有两种常见盐外,还含有极少量的NaOH;
ⅱ.取适量装置E中的溶液于试管中,滴入几滴紫色石蕊试液,溶液变蓝;
ⅲ.向步骤ⅱ中的蓝色溶液中逐滴滴入浓盐酸,颜色迅速褪去,过一会儿有刺激性气味的黄绿色气体生成。
①结合离子方程式说明颜色迅速褪去的原因:。
②产生黄绿色气体的离子方程式为。
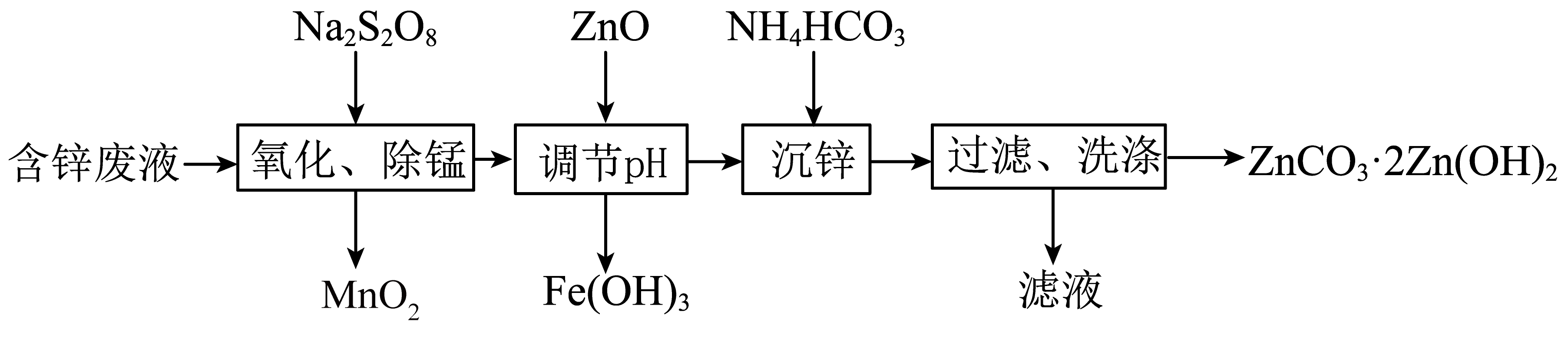
已知:还原性 Fe2+ > Mn2+;过二硫酸钠(Na2S2O8)中的硫显+6价。
请回答下列问题:
①该阶段需用玻璃棒不断搅拌,其目的是。
②生成MnO2的化学方程式为MnSO4+ Na2S2O8+ 2H2O =MnO2↓+2H2SO4+2Na2SO4 , 该反应的离子方程式为;试写出Na2S2O8将Fe2+氧化为Fe3+的离子方程式。
③不能用Cl2代替Na2S2O8 , 其原因是。