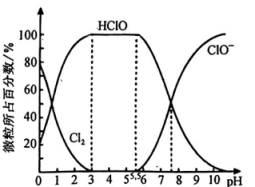
 B .
B .  C .
C .  D .
D . 
A | B | C | D |
|
|
|
|
验证NaCl是否是电解质 | 比较碳酸钠和碳酸氢钠的热稳定性 | 测定新制氯水的pH | 区分溶液与胶体 |
Ⅰ.如图为钠的价类二维图。
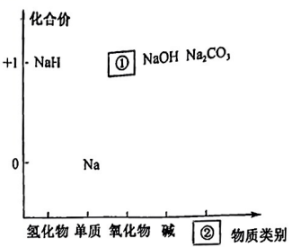
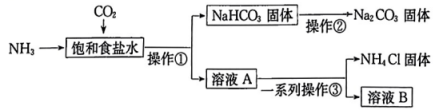
流程图中标注的物质属于电解质的有种,①~③所涉及的操作方法中,包含过滤的是(填序号)。
a.两种气体的先后顺序为先通入再通入
b.先析出的原因是
的溶解度小于
c.整个流程中涉及氧化还原反应
d.溶液B中的主要离子为 ,
,
,
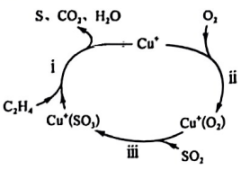
①中Al的化合价为。
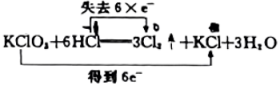
②上述反应中,被氧化的元素是(填元素符号),被氧化的元素(填“得到”或“失去”)电子;还原产物的化学式为。
③反应中每生成1个 , 转移个电子。
①
②
③
则、
,
的还原性由强到弱的顺序为(用“>”连接)。
①用玻璃棒蘸取少量溶液滴在红色石蕊试纸上,试纸变蓝;
②取少量原溶液于试管中,逐滴滴加盐酸至过量,有气体放出;
③再向②所得溶液中加入溶液,没有沉淀生成;
④再向③所得溶液中滴加足量硝酸酸化后,加入溶液,有白色沉淀生成。
回答下列问题: