 B .
B .  C .
C .  D .
D . 
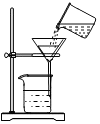 B . 给液体加热
B . 给液体加热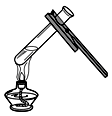 C . 称量固体
C . 称量固体 D . 处理废弃药品
D . 处理废弃药品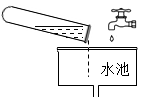
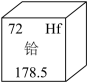
|
|
|
|
A.探究MnO2能否加快 H2O2的分解 | B.验证质量守恒定律 | C.测定空气中O2的含量 | D.比较不同物质的 着火点 |
 B .
B .  C .
C .  D .
D . 
 B . 测定空气中氧气的含量
B . 测定空气中氧气的含量  C . 用一定质量的高锰酸钾加热制氧气
C . 用一定质量的高锰酸钾加热制氧气 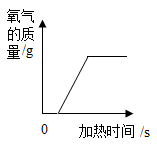 D . 加热氯酸钾和二氧化锰制氧气
D . 加热氯酸钾和二氧化锰制氧气 

a.水分子受热分解 b.水分子不断运动
c.水分子间隔变大 d.水分子数目减少


a.煤 b.沼气 c.天然气 d.乙醇汽油
A. B.
B. C.
C. D.
D.
①氨气极易溶于水,其水溶液称为氨水
②氨水在浓度大或受热时易分解放出氨气。
实验室用生石灰和浓氨水能快速制取氨气的原因是 ;制得的氨气 (填“能”或“不能”)用装置 D 收集。
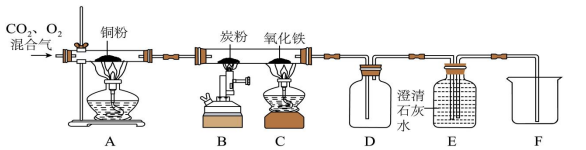
实验步骤 | 实验现象 | 实验分析 |
I:点燃A处酒精灯,缓缓通入混合气体。 | A中铜粉变①,B、C、D无明显现象,E中石灰水变浑浊。 | A玻璃管中铜粉的作用是除去CO2中的氧气。 |
II:点燃B处酒精喷灯,加热一段时间。 | 木炭粉减少,E中澄清石灰水变浑浊,F中有液体流入。 | B处发生反应的化学方程式为② |
III:点燃C处酒精灯 | C处的现象是③,E中澄清石灰C水变浑浊,F中有液体流入 | C处发生反应的化学方程式为④ |
IV:停止通入混合气体,用弹簧夹夹紧进气口,熄灭A、B、C三处火焰 | D中的现象⑤ | D的作用是防止玻璃管⑥。 |

i.电解水属于反应(填基本反应类型),反应前后氢元素的化合价(填“升高”“降低”或“不变”)。
ii.反应器 1:一定的H2环境及较低温度下CaCO3可与H2反应生成CaO、CO 和H2O。CO与H2O的分子个数比为。
CaCO3还可以直接分解。反应器 1中 CO、CO2的含量随反应温度的变化如下图所示。 ℃时,抑制 CO2生成的效果最好。

iii.反应器 2:一定条件下,CO与H2发生化合反应生成甲醇(CH3OH),化学方程式为 。

