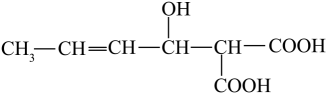
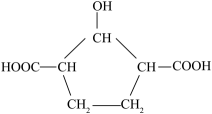
 互为同分异构体
D . 分子中所有碳原子可能在同一平面上
互为同分异构体
D . 分子中所有碳原子可能在同一平面上
选项 | 探究方案 | 探究目的 |
A | 用毛皮摩擦过的带电橡胶靠近CF2Cl2液流,液流方向改变 | CF2Cl2是极性分子 |
B | 将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去 | 铁锈中含有二价铁 |
C | 将中间裹有锌皮的铁钉(如图 | 铁钉能发生吸氧腐蚀 |
D | 用pH计分别测0.1 |
实验 | 实验操作及现象 |
1 | 用pH试纸测0.1 mol·L-1 NH4HC2O4溶液的pH<7 |
2 | 向10 mL 0.1 mol·L-1 NH4HC2O4溶液中滴加10 mL 0.1 mol·L-1Ba(OH)2溶液,产生白色沉淀,过滤 |
3 | 向实验2所得白色沉淀中加入10 mL饱和Na2CO3溶液,浸泡一段时间,无明显现象,过滤,向滤渣中滴加盐酸,有气体生成 |
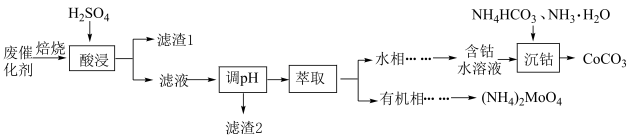
已知:①“焙烧”后各元素转化为相应氧化物,“酸浸”后钼元素转化为。
②常温下,Ksp(CoCO3)=a,Ksp(Co(OH)2)=b,Kb(NH3·H2O)=c。
沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 |
恰好完全沉淀时pH | 5.2 | 2.8 | 9.4 |
“滤渣2”的主要成分为Fe(OH)3和Al(OH)3 , “调pH”时,若浸取液中c(Co2+)=0.1mol·L-1 , 则需调节溶液pH的范围是(加入物质对溶液体积的变化忽略不计)。
已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:


VO+Fe2++2H+= VO2++Fe3++H2O;MnO
+5Fe2++ 8H+= Mn2++5Fe3++4H2O。
则V2O5样品的纯度为。(写出计算过程)
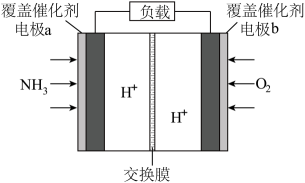
Ⅰ.模拟制备碱式氯化铜。
向CuCl2溶液中通入NH3 , 同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分加持装置已省略)

请补充完整测定氯的实验过程:取一定量碱式氯化铜固体,溶于稀硝酸,配制成一定体积待测液,准确量取25mL待测液于锥形瓶中,边振荡边向锥形瓶中滴加0.010 mol·L-1AgNO3溶液,直至静置后向上层清液中继续滴加0.010 mol·L-1AgNO3溶液无浑浊产生,记录消耗AgNO3溶液的体积V1 , ,重复上述实验2~3次。
已知:①Ag+ + SCN— = AgSCN↓(白色沉淀);②聚乙烯醇可以覆盖在AgCl表面,阻止AgCl转化为AgSCN。[须使用的实验试剂:0.010 mol·L-1NH4SCN标准溶液、Fe(NO3)3溶液、聚乙烯醇]
Ⅰ.工业上利用两种温室气体CH4和CO2催化重整制取H2和CO,主要反应为:
反应①:
过程中还发生三个副反应:
反应②:
反应③:
反应④: △H4
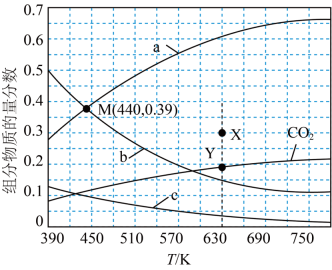
将CH4与CO2(体积比为1∶1)的混合气体以一定流速通过催化剂,产物中H2与CO的物质的量之比、CO2的转化率与温度的关系如图所示:
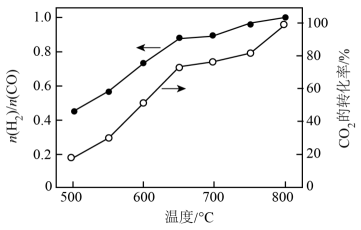

上述反应机理中表现出氧化性的粒子有。


, 其中,Qx=nF,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
当电解电压为u1V时,阴极生成HCHO的电极反应式为。