
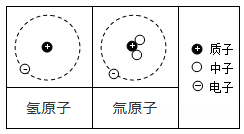
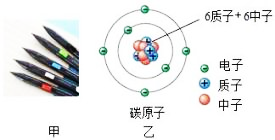
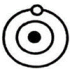
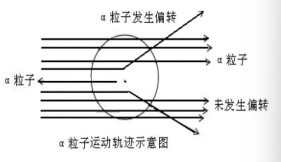
现象1:大多数α粒子能穿透金箔而不改变原来运动方向;现象2:少部分α粒子改变原来的运动方向;
现象3:极少数α粒子被弹了回来。
 B .
B . 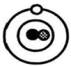 C .
C . 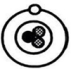 D .
D . 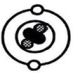

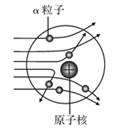
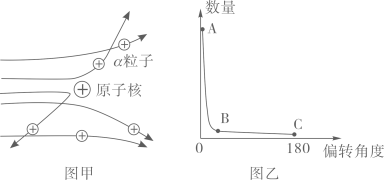
[收集证据]绝大多数α粒子穿过金箔后仍沿原来的方向前进,只有少数α粒子发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
[猜想与假设] α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
[解释与结论]
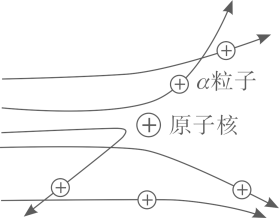
现象 1:大多数α粒子能穿透金箔而不改变原来的运动方向。
现象 2:一小部分α粒子改变原来的运动方向。
现象 3:极少数α粒子被弹了回来。
请回答下列问题:
[查阅资料]成人每天食用食盐的质量通常为6 g,
某种加碘食盐的标签如图所示。

[问题分析]500 g该品牌食盐中,含碘的最大质量是;若要使人体甲状腺中的碘达到饱和,至少需要一次性食用该品牌碘盐。
[结论]日常服用加碘食盐(填“能”或“不能”)起到避免核辐射的目的,原因是。

| 时间 | 人物 | 对“原子—分子”的认识 |
| 1803年 | 道尔顿 | 元素由微小的不可分的原子组成;不同元素的原子以简单数目比形成不可再分的原子——“复杂原子”。 |
| 1809年 | 盖·吕萨克 | 在同温同压下,相同体积的不同气体中含有相同数目的原子(包括“复杂原子”)。 |
| 1811年 | 阿伏加德罗 | 提出分子学说。引入分子概念,指出分子与原子的区别和联系。随后科学家们确立并逐步完善了“原子—分子”学说。 |
| 1897年 | 汤姆生 | 提出电子嵌于原子表面的枣糕型原子结构,否定了“原子不可再分“的观点。 |
| 1903年 | 卢瑟福 | 用a粒子轰击金箔的实验,推翻了汤姆生提出的原子结构模型,为建立现代原子理论打下了基础。 |
