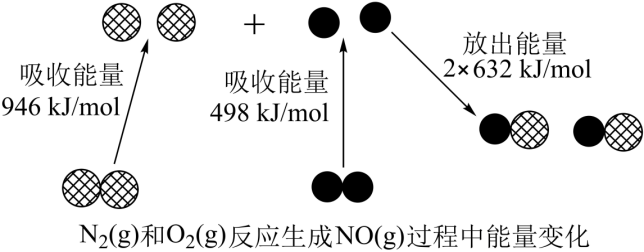

a(g)+b(g)⇌2c(g);△H1<0
x(g)+3y(g)⇌2z(g);△H2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是( )
 B .
B .  C .
C .  D .
D . 
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol | 0.8 | 2.7 | 0.8 | 27 |
3 min末/mol | 0.8 |
已知2 min内v(Q)=0075 mol·L-1·min-1 , =0.5

a. b.容器内压强保持不变
c.容器内密度保持不变 d.
已知:CH4(g)+ H2O(g) = CO(g)+3H2(g) ΔH =-206.2kJ·mol-1
CH4(g)+ CO2(g) = 2CO(g)+2H2(g) ΔH =-247.4kJ·kJmol-1
2H2S(g) = 2H2(g)+S2(g) ΔH =+169.8kJ·kJmol-1


在一个小烧杯里,加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片(或三合板)上,然后再加入约10 g NH4Cl晶体,并立即用玻璃棒迅速搅拌。
试回答下列问题:
②试用简单的方法说明烧杯与玻璃片之间是因“结冰”而黏在一起的。
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1 , 各物质的密度均为1 g·cm-3。
①计算完成上表
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:;