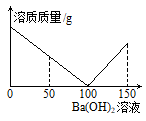
步骤Ⅰ:取少量样品于烧杯中,加足量水,充分搅拌,有白色不溶物产生。
步骤Ⅱ:取步骤Ⅰ的白色不溶物,加入足最稀盐酸,固体完全溶解,且有气泡产生。
步骤Ⅲ:取少量步骤Ⅰ所得的无色滤液,通入二氧化碳气体,有白色沉淀生成。
【查阅资料】CO2不能直接与BaCl2成MgCl2发生反应。
请回答下列问题:
|
|
加入的 试剂 |
实验现象 |
实验结论 |
|
方法1 |
锌粒 |
A中无明显现象;B中产生气泡 |
A是____ B是____ |
|
方法2 |
碳酸钠 溶液 |
A中____ B中____ |
化学小组同学对方法2进一步探究,设计了如下实验方案。
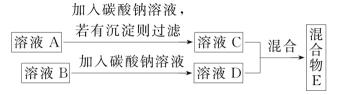
溶液C和溶液D混合,可能有以下三种情况:
[提出问题]这瓶试剂是什么溶液
[猜想]猜想一:NaHCO3溶液
猜想二:NaOH溶液
猜想三:Na2CO3溶液
猜想四:NaCl溶液

[查阅资料]上述四种物质的相关信息如下表所示。
物质 | NaHCO3 | NaOH | Na2CO3 | NaCl |
常温下溶解度/g | 9.6 | 109 | 21.5 | 36 |
常温下稀溶液的pH | 9 | 13 | 11 | 7 |
探究1:取瓶中溶液少许于试管中,滴加几滴酚酞溶液,溶液变红。
实验探究2:另取瓶中溶液少许于试管中,滴加足量的稀盐酸,产生气泡。
小组同学从四种物质的相关信息推知:猜想一也是错误的,理由是。
小组同学分析实验探究2并结合以上同学的实验结论,认为瓶中原溶液是Na2CO3溶液。
实验探究2中发生反应的化学方程式为。
[提出质疑]有同学认为瓶中原溶液是Na2CO3溶液的分析也不严密,需要进一步实验确定,于是他们又进行了如下探究。
实验探究3:在实验探究1试管中的红色溶液中滴加过量氯化钡溶液(中性),有白色沉淀产生,溶液仍呈红色。
[反思总结]化学试剂取用后应立即盖紧瓶塞,防止与空气中的物质发生反应而变质。

【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】这瓶溶液是:猜想一:氯化钠溶液;猜想二:氢氧化钠溶液;猜想三:碳酸钠溶液。
【实验推断】
【继续探究】
另取样加入过量的溶液,观察到有产生,设计这一步骤的目的是;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
这瓶溶液是。
若该溶液与盐酸发生中和反应,恰好完全反应的微观过程如图所示,反应的实质表达式为: , 则反应后溶液中存在的阴、阳离子是(填符号)。

实验中加溶液反应的实质表达式:(用化学符号表示)