, 下列说法正确的是( )(
为阿伏加德罗常数的值)
| 原料 | 反应条件、组成或结构改变 | 效果 |
A | 碳素钢 | 改变合金元素 | 得到性能不同的特种钢 |
B | 高分子聚合物 | 增加强亲水基团 | 产生高吸水性树脂 |
C | 头发 | 二硫键的断裂与形成 | 定型成需要的形状 |
D | 苯酚、甲醛 | 控制反应条件,主要生成2,4,6-三羟甲基苯酚中间体 | 得到线型结构酚醛树脂 |
A | B | C | D |
|
|
|
|
验证双液原原电池的工作原理 | 比较C与Si的非金属性强弱 | 用电石制备乙炔并验证乙炔的性质 | 探究铜与浓硫酸的的反应 |


| 图a装置 | 图b装置 | 图c装置 |
80s时反应区 | x |
下列说法正确的是( )
| 实验目的 | 实验方案设计 | 现象 | 结论 |
A | 探究 | 向 | 溶液变蓝色 | 氧化性: |
B | 比较 | 常温,测定 | 结合 | |
C | 探究温度对化学平衡的影响 | 将 | 加热后溶液为黄绿色,冷水中变为蓝绿色 | 说明降低温度
|
D | 比较AgCl与 | 向含有浓度均为 | 先生成白色AgCl沉淀 | Ksp: |
。(电负性:
)
下列说法正确的是。
A.原子半径:
B.GaAs为共价晶体,为分子晶体
C.沸点:
D.化学键中离子键成分的百分数:
②比较键角:
中的
中的
(填“>”“<”或“=”),请说明理由

如图所示晶胞沿着z轴的投影图为(填选项字母)。
A.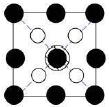 B.
B. C.
C.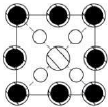 D.
D.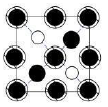
已知:①主要副反应为
②温度过高会引发烃裂解生成炭(C)。
③相关化学键的键能如下所示:
化学键 | ||||
键能 | 615 | 436 |
请回答:
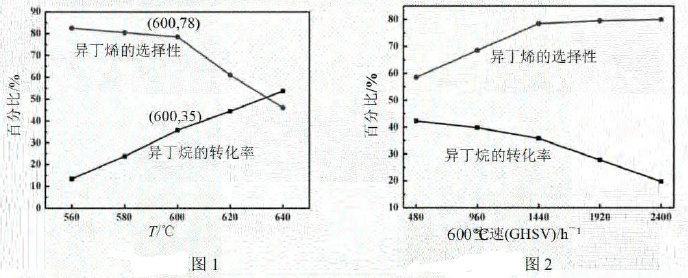
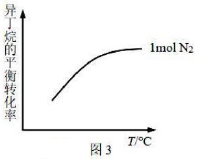
①图1中,600℃时异丁烯收率。
②下列说法正确的是。
A.由图1可知,温度越高,产生异丁烯的速率越快
B.混入的目的之一是减小异丁烷的吸附速率,同时带走催化剂局部多余的热量,从而抑制催化剂的积碳
C.图2中,空速增加,异丁烷转化率降低的原因可能是原料气在催化剂中停留时间过短
D.图2中,空速增加,异丁烯选择性升高的原因可能是原料气将产物迅速带走,抑制了副反应的发生
③图1中,随着温度升高,异丁烷转化率增大而异丁烯选择性下降的原因可能是。
④其他条件相同,异丁烷的平衡转化率如图3所示。若充入改为2mol,在图3中作出异丁烷的平衡转化率随温度变化的曲线(忽略积碳的影响)。
()→()→a→()→e→f→()
a.调节三通阀如图![]() , 收集气体一段时间
, 收集气体一段时间
b.开启装置A磁力搅拌器,慢慢加入一定量硫酸
c.调节装置B温控磁力搅拌器,并控制温度为30℃
d.调节装置B温控磁力搅拌器,并迅速控温在85℃
e.调节三通阀如图![]()
f.移动水准管并调节活塞Y控制气体流速,反应一段时间后
g.检测气体纯净后连接三通阀
A.冷水 B.热水 C.乙醚 D.滤液
滴定反应:
主要步骤:
Ⅰ.称取mg产品用蒸馏水溶解并定容至500mL。移取该溶液注入碘量瓶中,加
碘标准液,20mL氢氧化钠溶液,于暗处放置10min。加适量水及盐酸摇匀,用
硫代硫酸钠标准溶液滴定,近终点时,加3mL淀粉指示液 , 继续滴定至终点,消耗体积
。
Ⅱ.空白实验:将上述样品溶液改为蒸馏水注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积
。
①需要加入淀粉指示液时,锥形瓶中溶液的现象是。
②产品的质量分数为。
利用以上合成路线的相关信息,设计该合成路线(用流程图表示,无机试剂任选)。
①分子中含有苯环,无其他环状结构;
②谱和IR谱检测表明:分子中共有3种不同化学环境的氢原子,且无
![]() 结构。
结构。