选项 | 金属(粉末状)及其物质的量/mol | 酸的浓度及体积 | 反应温度/℃ |
A. | Mg 0.1 | 8 mol∙L-1硝酸 10mL | 30 |
B. | Mg 0.1 | 3 mol∙L-1盐酸 10mL | 30 |
C. | Fe 0.1 | 6 mol∙L-1盐酸 10mL | 30 |
D. | Mg 0.1 | 3 mol∙L-1硫酸 10mL | 30 |
①适当升高温度;②再加入100mL的稀盐酸;③加少量
固体;④加入少量醋酸钠固体;⑤加几滴浓硫酸;⑥滴入几滴硫酸铜溶液。

选项 | 试剂X | 收集气体 | 试剂Y |
A. | 碱石灰 | 氯化氢 | 水 |
B. | 碱石灰 | 氨气 | 水 |
C. | 五氧化二磷 | 二氧化硫 | 氢氧化钠溶液 |
D. | 氯化钙 | 一氧化氮 | 氢氧化钠溶液 |

已知:①的熔点为-116℃、沸点为3.8℃,具有强烈刺激性气味、易溶于水;②
与有机物、还原剂接触或加热时会发生燃烧并爆炸。
下列说法中正确的是( )
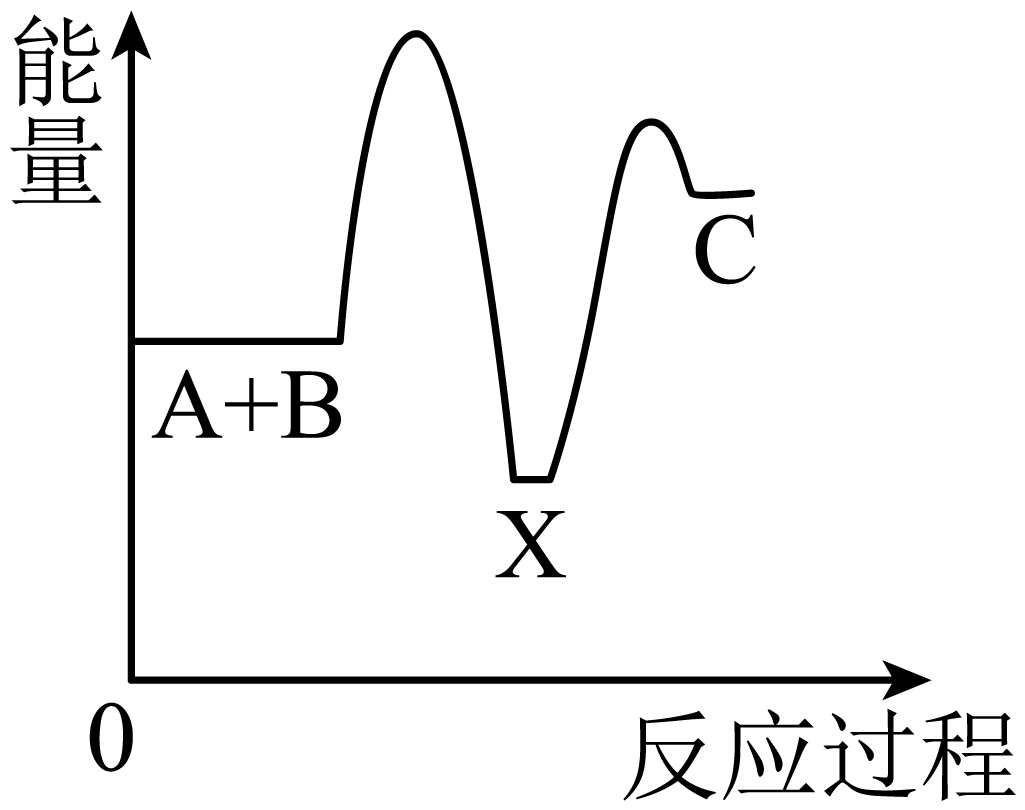 B .
B .  C .
C .  D .
D . 
| 操作 | 现象 | 结论 |
A. | 向NaBr溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈橙色 | 还原性: |
B. | 将氯气缓缓通入到紫色的石蕊溶液中 | 石蕊溶液先变红后褪色 | 氯气与水反应生成了酸性物质和漂白性物质 |
C. | 将装满氯水 | 烧瓶内有气泡生成 | 日光照射时,逸出的气体只可能是 |
D. | 分别加热 | 试管内壁都有水珠 | 两种物质均受热分解 |

①反应在c点到达平衡
②SO2浓度:a点小于c点
③反应物的总能量低于生成物的总能量
④ , ab段NO2的消耗量小于bc段NO2的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
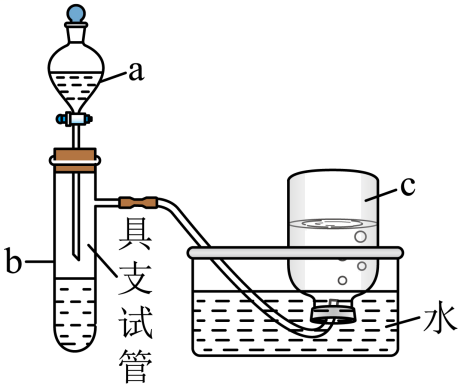
将铜片置于具支试管的底部,在分液漏斗中加入约5mL浓硝酸,往具支试管中放入约2mL浓硝酸,集气瓶c中收集到一种无色气体。
仪器a的名称为。上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,可以将浓硝酸稀释后加入具支试管再与铜片反应,此时发生反应的离子方程式是;集气瓶c中仍收集到一种无色气体,此时向集气瓶c中通入一定量的氧气后集气瓶c中逐渐充满无色溶液,请写出通入一定量的氧气后集气瓶c中发生的总反应方程式。
用等质量铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因,是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
你认为上述看法(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:。


①0~10min内该反应的平均速率。
②从11min起其他条件不变,压缩容器的容积变为1L,则的变化曲线可能为图中的(填字母)。
③恒温恒容条件下,不能说明该反应已经达到平衡状态的是(填标号)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
D.容器内混合气体平均相对分子质量保持不变
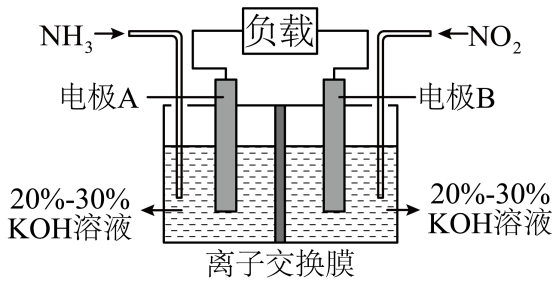
电极A是原电池的(填“正极”或“负极”),发生(填“氧化反应”或“还原反应”),电极B上发生的电极反应为。


①操作V加入溶液调节溶液pH的过程中有
产生,则
溶液与
溶液反应的离子方程式为;
②操作VI中需要的玻璃仪器有;
③你认为操作VII中检测的方法及现象是时可继续进行操作VIII;
④操作VIII中用无水乙醇洗涤的目的是。