

选项 | 操作 | 目的 |
A | 用剩的食盐放回原试剂瓶 | 避免浪费 |
B | 天平调平后在托盘中垫纸 | 保证称取的食盐质量更准确 |
C | 用50ml量筒替代天平量取所需的水 | 更加简便 |
D | 溶解时用玻璃棒搅拌 | 提高食盐的溶解能力 |
 B .
B .  C .
C .  D .
D . 




 B .
B . 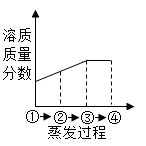 C .
C .  D .
D . 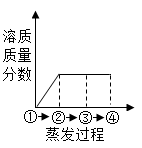
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | |
| 溶解度/g | 甲 | 0.18 | 0.16 | 0.14 | 0.12 | 0.09 |
| 乙 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | |
| 丙 | 13.3 | 31.6 | 63.9 | 110 | 169 | |





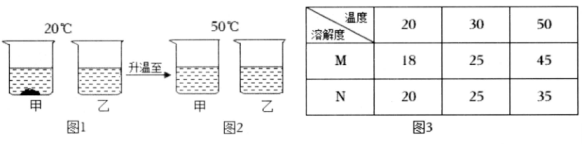
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |



 B .
B .  C .
C .  D .
D . 

【药品器材】水、氯化铵、氯化钙、氯化钠;烧杯、药匙、玻璃棒、量筒、温度计等。
【实验探究】三种物质各取1药匙于烧杯分别溶于水,另还有一个烧杯只加水,用温度计测量液体温度,并记录有关数据如下:
|
实验 |
水的体积 |
所加物质 |
测量液体温度(℃) |
|
实验1 |
50mL |
氯化铵 |
15 |
|
实验2 |
50mL |
氯化钙 |
28 |
|
实验3 |
X |
氯化钠 |
21 |
|
实验4 |
50mL |
无 |
22 |


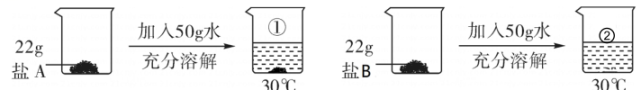
A.溶解食盐的烧杯用水洗涤后未干燥就使用
B.加水溶解过程中有少量水溅出
C.量取水的操作中仰视量筒凹液面最低处读数
D.食盐中含有少量泥沙

②纠正错误后,正确称量氯化钠时,若发现天平指针向左偏,接下去的操作是。
|
过氧乙酸(1L) |
|
|
溶质质量分数 |
20% |
|
密度 |
1.2 g/cm3 |
|
强腐蚀性、阴冷处存放 |
|
