①实验室收集氨 气采用图1所示装置②实验室中做氯气与钠的反应实验时采用图2所示装置③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验④实验室中采用图3所示装置进行铜与稀硝酸的反应

①氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚 ②氧化铁常用作红色油漆和涂料 ③硅酸钠是制备硅胶和木材防火剂的原料 ④以纯碱、石灰石、石英为原料可制普通玻璃 ⑤石灰石、高岭石、石英和水晶的主要成分都是SiO2
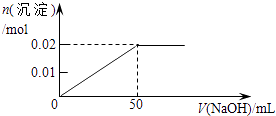 B .
B . 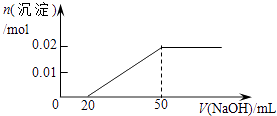 C .
C .  D .
D . 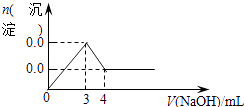

成 分 | 质 量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
①测知溶液显强酸性;②取样加少量CCl4和数滴新制氯水,CCl4层为紫红色;
③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程中均无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿红色石蕊试纸变蓝。
请回答:原溶液中肯定存在的离子是;不能确定是否存在的离子是
其中KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
①写出并配平该氧化还原反应的方程式。
②反应中硝酸体现了、性质。
③反应中若产生0.2mol气体,则转移电子的数目是。
④若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是
来补充铁,则正常人每天服需用含mgFeSO4·7H2O的片剂。

①在该实验中,甲部分的装置是(填字母)。

②乙装置中FeCl2溶液与Cl2反应的离子方程式是。
③丙装置中通入少量Cl2 , 可制得某种生活中常用的漂白、消毒的物质,这种物质是(化学式)。
④有人认为该实验存在明显的缺陷,请你将认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂。
请你写出Cl2和“④”中“最合适的化学试剂”反应的离子方程式。