①钠的还原性很强,可以置换出硫酸铜溶液中的铜单质
②氧化铝可制作耐火坩埚,只因为氧化铝的化学性质很稳定
③发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
④Na2O2和Na2O均可作呼吸面具中O2的来源
⑤明矾常作为消毒剂
⑥碳酸钠在医疗上是治疗胃酸过多的一种药剂.
①钠与水反应生成NaOH和H2 , 所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈,性质更活泼的铝不能稳定存在于空气中
③Cu(OH)2受热易分解,Fe(OH)3受热也易分解
④Al(OH)3能与NaOH反应,Be(OH)2也能与NaOH反应.


铁及其化合物在生产和生活中有广泛的应用.
(1)铁元素在元素周期表中的位置为 .
(2)等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下反应,产生相同条件下的气体体积比为 ,铁在高温条件下与水蒸气反应的化学方程式为 .
(3)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
①加入少量NaHCO3的目的是调节pH,应控制pH的范围为 .
②碱式硫酸铁溶于水后产生的[Fe(OH)2+]离子,可部分水解生成聚合离子[Fe2(OH)42+].该水解反应的离子方程式为 .
(4)高铁酸钾(K2FeO4)也是常用的水处理剂.它的制备方法有多种.
①熔融法又称为过氧化钠氧化法.先在高温熔融的条件下制备高铁酸钠:Fe+3Na2O2=Na2FeO4+2Na2O,再将高铁酸钠加入到氢氧化钾溶液里,发生反应:2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析该反应发生的原因: .
②电解法制备高铁酸钾.铁和石墨分别做两个电极的电极材料,氢氧化钠溶液做电解液实现电解制备.阴极的电极材料为 , 写出阳极的电极反应式为 .

已知:HCNO的结构式是:H﹣O﹣C≡N
HCN的Ka=6.02×10﹣10
[Ag(CN)2]﹣(aq)⇌Ag+(aq)+2CN﹣(aq) K=1.3×10﹣21
回答下列问题:
CN﹣被氯气氧化成低毒的CNO﹣ , 写出相应的离子方程式,
CNO﹣被氯气氧化成无毒的两种气体,写出相应的离子方程式

其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(i)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式:.
(ii)④中加入的X可能是
(iii)④⑤两步的目的是.
(iv)写出⑥的化学反应方程式.
(i)写出生成TiCl4的化学反应方程式
方法二是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.
(ii)阴极反应的电极反应式为.
(iii)电解过程中需定期向电解槽池中加入碳块的原因是.
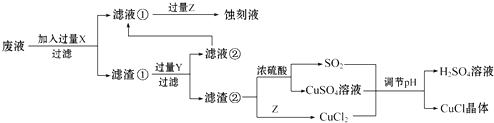
根据以上信息回答下列问题:
|
pH |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
CuCl产率/% |
70 |
90 |
82 |
78 |
75 |
72 |
70 |
析出CuCl晶体最佳pH为,当pH较大时CuCl产率变低原因是.调节pH时,(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是.
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解.
②用0.10mol•L﹣1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+ . 三次平行实验结果如下(平行实验结果相差不能超过1%):
|
平行实验次数 |
1 |
2 |
3 |
|
0.25g样品消耗硫酸铈标准溶液的体积(mL) |
24.35 |
24.05 |
23.95 |
则样品中CuCl的纯度为(结果保留三位有效数字).