



①HSLA-100是一种航母甲板用钢,不属于这种钢材性质的是(填字母)。
a.强度大 b.耐高温 c.密度小
②航母拦阻索最初由剑麻纤维和钢丝编织而成,现以尼龙和钢丝编织为主,下一代采用材质将是碳纤维。下列属于天然高分子材料的是(填字母)。
a.剑麻纤维 b.尼龙 c.碳纤维
③航母信息系统上大量使用光导纤维,光导纤维的成分是(填字母)。
a.3CaO·SiO2 b.SiO2 c.聚异戊二烯
①配料中,属于防腐剂的是(填名称);钙、锌、硒、磷四种元素中属于微量元素的是(填元素名称)。
②鱼粉蛋白质水解能生成多种氨基酸,写出甘氨酸的结构简式:。
③配料中淀粉在人体中完全水解的化学方程式为。
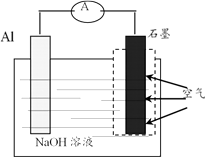
①用清洁能源替代传统的化石能源是预防酸雨的有效途径之一。通常人们所说的酸雨,其主要有害成分是(填两种强酸的化学式);积极推广可降解塑料,减少使用聚乙烯等塑料,可防治的环境污染称为。
②纳米铁可修复被C2HCl3、NO 污染的地下水。C2HCl3在纳米铁作用下,Cl被H取代最终转化为一种气态烃,该气态烃的结构简式为;NO3-在酸性条件下被纳米铁还原为N2(Fe被氧化为Fe2+)的离子方程式为。
③绿色合成是从源头上防治污染的前沿学科。水杨酸与(CH3CO)2O在绿色催化剂明矾催化下可生成阿司匹林和乙酸,该反应的化学方程式为。
①下列物质易溶于水的是(填字母)。
a.异丁烷 b.乙醇 c.氯乙烯
②下列物质不能发生水解反应的是(填字母)。
a.葡萄糖 b.溴乙烷 c.乙酸乙酯
③可用酸性KMnO4溶液鉴别的一组物质是(填字母)。
a.甲烷与乙烷 b.乙烯与乙炔 c.苯和甲苯
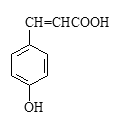
①对香豆酸分子中位于同一平面的碳原子最多有个。
②1mol对香豆酸最多可与 molH2发生加成反应。
③聚对香豆酸的结构简式为。

①A→B的反应类型是;C中的含氧官能团名称为和(填二种)。
②X的分子式为C2H2O3 , B→C为加成反应,X的结构简式为。
③芳香化合物Y是D的同分异构体,Y既能与NaHCO3反应生成CO2又能发生银镜反应,苯环上的一硝基取代物只有二种。符合题意的Y的结构简式为。


①称取0.1600g草酸亚铁于锥形瓶中,加入25mL 2 mol·L-1的H2SO4溶液,加热至40~50℃,使样品溶解。
②用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液23.80mL。
[5C2O42-+ 2MnO4-+16H+=10CO2↑+2Mn2++8H2O ;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O]
③在②滴定后的溶液中加入足量Zn粉(2Fe3++Zn = 2Fe2++Zn2+)和5mL 2 mol·L-1 的H2SO4溶液,煮沸约10min。
④将滤液过滤至另一个锥形瓶中,用10mL 1 mol·L-1的H2SO4溶液洗涤锥形瓶,将全部Fe2+转移入锥形瓶中,再用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积8.00 mL。
(I)测得的产品中n(Fe ) ∶n(C2O
) 1∶1(填“>” “=”或“<”)。
(II)请计算产品中C2O 的质量分数(写出计算过程)。