
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量(g) | 4.6 | 8.8 | 0 | 0 | 0 |
反应后质量(g) | 0 | 0 | 6.6 | a | 1.4 |
①表中a的值为。
②该实验发生反应的化学方程式为:
+CO
求:92g乙醇完全燃烧需消耗多少g氧气?

①;②
实验步骤 | 相关数据 |
①称取生铁样品放入烧杯中 | 16g |
②加入足量15%的盐酸 | 200.0g |
③称取反应后烧杯中物质总质量 | 215.5g |
根据表中数据,计算:
①产生氢气的是 g.
②生铁样品中铁的质量.
【实验一】将100g大理石样品放入硬质玻璃管中高温加热,在不同反应时间测得的实验数据如下表(大理石高温加热的反应方程式是:CaCO3 CaO+CO2↑,杂质不反应):
|
反应时间/min |
0 |
5 |
9 |
12 |
15 |
|
剩余固体质量/g |
100 |
91.2 |
73.6 |
64.8 |
64.8 |
【实验二】将100g大理石样品放入一定量的稀盐酸中,充分反应后测得实验数据如如图(杂质不与稀盐酸反应,气体的溶解忽略不计):
根据实验及有关数据进行分析:
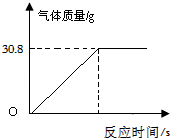
【实验小组根据实验二】数据计算出样品中杂质的质量为30g.经检查无计算原理及数字运算错误.请判断【实验二】的测定结果是否正确,如不正确要指出错误的原因.