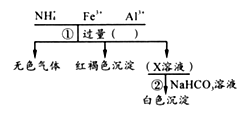

主反应 2CH3CH2OH CH3CH2OCH2CH3+H2O
副反应CH3CH2OH H2C=CH2 ↑+H2O

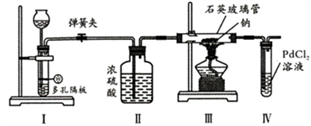
【乙醚制备】装置设计如下图(部分装置略)
A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
a.安装实验仪器 b.加入12 mL浓硫酸和少量乙醇的混合物 c.检查装置气密性 d.熄灭酒精灯 e.通冷却水并加热烧瓶 f.拆除装置 g.控制滴加乙醇速率与馏出液速率相等
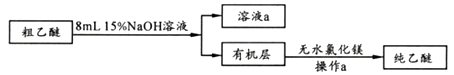
粗乙醚中含有的主要杂质为;无水氯化镁的作用是。
CO(g)+2H2(g) CH3OH(l) △H=x。
①该化学反应0~10 min的平均速率v(H2)=;M和N点的逆反应速率较大的是(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为。
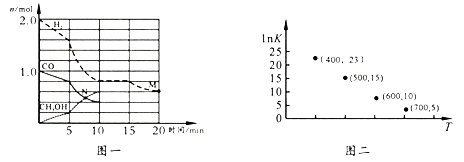
③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是。
①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为。
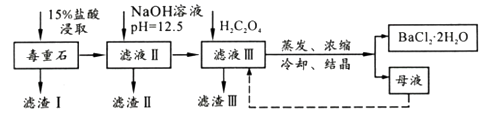
已知:①Ksp(BaC2O4)=1.6×10-7 , Ksp(CaC2O4)=2.3×10-9
②离子浓度小于至1×10-5认为沉淀完全。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
温度(℃) | 常温 | 190〜200 | 470〜480 |
质量(g) | 146.0 | 128.0 | 100.0 |
滤渣III 的成分是(填化学式);200~470℃时发生反应的化学方程式为。
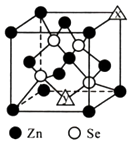
硒化锌是一种半导体材料,回答下列问题。
A.CO32-
B.NO3-
C.NCl3
D.SO32-
防晒剂(M)CH3O ![]() CH=CHCOOCH2CH2CH2CH3的合成路线如下,根据信息回答下列问题:
CH=CHCOOCH2CH2CH2CH3的合成路线如下,根据信息回答下列问题:
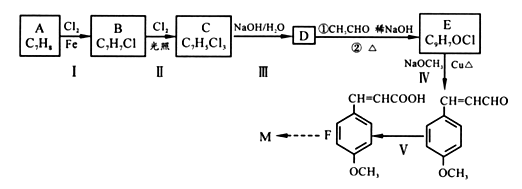
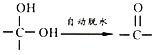
已知:①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
② ![]()
a.苯环上有3 个取代基
b.仅属于酯类,能发生银镜反应,且每摩该物质反应时最多能生成4molAg
c.苯环上的一氯代物有两种