实验目的 | 实验操作 | |
A | 检验溶液中的Fe2+ | 先滴加新制氯水,再滴加KSCN溶液 |
B | 配制0.5mol/L的H2SO4溶液 | 量取50mL1.0 mol/L H2SO4溶液,倒入小烧杯中,再加入50mL水稀释 |
C | 验证乙烯的生成 | 加热乙醇和浓硫酸混合液,将气体通入酸性KMnO4溶液 |
D | 除去乙酸乙酯中混有的乙酸 | 用过量饱和碳酸钠溶液洗涤后分液 |
【查阅资料】
i.氢氧化铜是一种蓝色絮状沉淀,难溶于水,溶于酸、氨水等,受热会分解。
ii.碳酸铜是蓝绿色粉末状固体,受热易分解,遇水转化为氢氧化铜和碱式碳酸铜的混合物。
iii.碱式碳酸铜呈孔雀绿颜色,又叫孔雀石,难溶于水,溶于酸、氨水等,在空气中加热会分解。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为CuCO3
假设3:沉淀为碱式碳酸铜[化学式可表示为xCuCO3•yCu(OH)2]
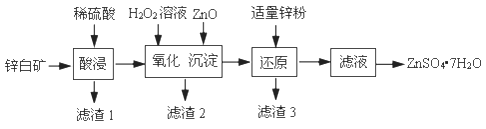
实验小组同学将沉淀从溶液中分离并净化,取少量净化后的固体于试管中,滴加稀硫酸,观察到,证明假设3成立。
为了确定碱式碳酸铜化学式中x与y的关系,实验小组称取净化后的蓝绿色固体m1 g,使用下列装置(夹持仪器未画出)进行实验。
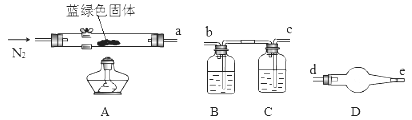
B,C,D中的试剂依次为(填标号)。
a.澄清石灰水
b.碱石灰
c.氯化钙溶液
d.浓硫酸
已知:Ksp[Fe(OH)3]=4.0×10−38 , Ksp[Cu(OH)2]=2.2×10−20
时间 物质的量 | 5 min | 10 min | 15 min | 20 min | 25 min |
n(N2)/mol | 0.36 | 0.35 | 0.275 | 0.25 | 0.25 |
n(H2)/mol | 0.48 | 0.45 | 0.225 | 0.15 | 0.15 |
n(NH3)/mol | 0.08 | 0.1 | 0.25 | 0.30 | 0.30 |
①5~10 min内,生成NH3的平均反应速率是 mol/(L·min)。
②下列能作为判断该反应达到化学平衡状态的依据是(填字母序号)。
A.v(N2)正=3v(H2)逆
B.容器内压强保持不变
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是。
相关化学键键能数据如下:
化学键 | H—H | N≡N | N—H |
E /(kJ/mol) | 436 | 946 | 391 |
由此计算ΔH=kJ/mol,低温下,合成氨反应(填“能”或“不能”)自发进行。已知合成氨反应N2(g)+3H2(g) 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
N2(g)+3H2(g)的活化能Ea2=kJ/mol。
反应Ⅰ:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =﹣906kJ/mol
反应II:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
①该条件下,N2(g)+O2(g) 2NO(g) △H = kJ/mol
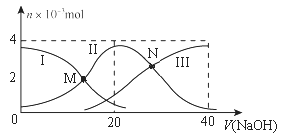
②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2 , 测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应(填“反应Ⅰ”或“反应II”)。520℃时,反应Ⅰ的平衡常数K=(只列算式不计算)。
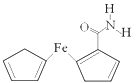
 ,请以丙酮(CH3COCH3)、乙醇为原料制备A,写出相应的合成路线流程图(无机试剂任选)。
,请以丙酮(CH3COCH3)、乙醇为原料制备A,写出相应的合成路线流程图(无机试剂任选)。