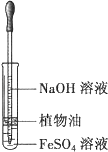
 观察Fe(OH)2的生成
B .
观察Fe(OH)2的生成
B . 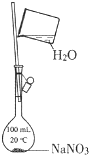 配制一定物质的量浓度的NaNO3溶液
C .
配制一定物质的量浓度的NaNO3溶液
C . 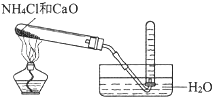 实验室制取氨
D .
实验室制取氨
D . 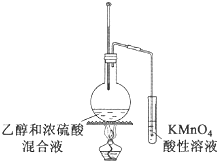 验证乙烯的生成
验证乙烯的生成
|
A |
B |
C |
D |
|
将二氧化硫通入 到一定量氯水中 |
将氨水滴入到一定 量氯化铝溶液中 |
将铜粉加入到 一定量浓硝酸中 |
将铁粉加入到一 定量氯化铁溶液中 |
|
|
|
|
|
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: 2Fe+6H+═2Fe3++3H2↑ | 正确 |
B | 大理石溶于醋酸的反应: CaCO3+2H+═Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | FeCl3溶液“腐蚀”铜箔: Fe3++Cu═Fe2++Cu2+ | 正确 |
D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH﹣ | 错误,HCO3﹣也可以与OH﹣反应 |
①HCl比H2S稳定
②HCl和H2S的水溶液前者的酸性强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3 , S与Fe反应生成FeS.
①铁能被磁铁吸引,但纯铁易腐蚀
②在人体的血红蛋白中含有铁元素
③铁位于元素周期表中第四周期第ⅧB族
④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧
⑤铁与强氧化剂硝酸反应的产物仅是Fe(NO3)3
⑥不能通过化合反应制得FeCl2和Fe(OH)3 .




请根据图象回答下列问题:

根据以上实验事实,回答下列问题:

①E元素在元素周期表中的位置是.
②由D和F,Y,Z所形成的最简单常见共价型化合物中,还原性最强的是(用化学式表示).
③F,X,Z形成的简单离子半径从大到小顺序为(用离子符号表示).
④X与Z能形成一种离子化合物,用电子式表示其形成过程:.
⑤2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是.
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |