|
|
|
|
A.胶头滴管 | B.长劲漏斗 | C.量桶 | D.水槽 |
实验目的 | 实验方案 | |
A. | 鉴别氧气、氢气、二氧化碳 | 燃着的木条 |
B. | 测定粗盐纯度 | 溶解、过滤、蒸发结晶 |
C. | 从氯酸钾制氧气的剩余物中回收二氧化锰 | 溶解、过滤、蒸发结晶 |
D. | 鉴别稀盐酸与稀硫酸 | 取样,滴加硝酸银溶液 |
以上物质中,可填充飞艇的是(写化学式,下同),含有原子团的是焰色反应火焰呈黄色的是,可除铁锈的是。
①水的组成
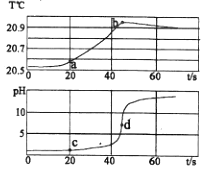
I.宏观现象:如图玻璃管a、b中产生气体的体积比约为,检验b中气体的现象是;
II.微观分析:该反应中发生分解的微粒名称是;
III.符号表达:电解水的化学方程式为。
②水的性质
I.将少量淀粉加入水中,充分搅拌后可形成(填“溶液”、“悬浊液”、“乳浊液”);
II.沿海地区温差比内陆小的主要原因是。
③水的用途
I.碘与镁在常温下化合速度很慢,若滴入几滴水则反应剧烈,水在此的作用是。
II.下列实验中,对水的作用分析有错误的是(填字母)
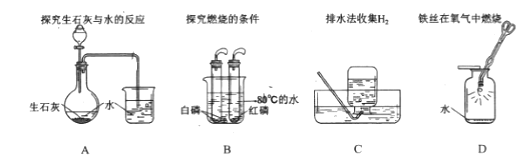
A.烧杯中的水便于观察烧瓶内气压变化
B.提供热量
C.排尽空气且便于观察H2何时集满
D.防止熔融物炸裂集气瓶
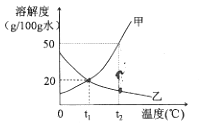
①t1℃时,甲物质的溶解度为 g/100g 水;
②t2℃时,将50g甲放入100g水中,充分搅拌后所得溶液的溶质质量分数为;
③t1℃时,将甲、乙的饱和溶液分别升温至t2℃,此时要使甲、乙溶液的浓度相等,可实现的下一步操作是。
A.向甲溶液中加入固体甲
B.向甲溶液中加入水
C.向乙溶液中加入固体乙
D.向乙溶液中加入水
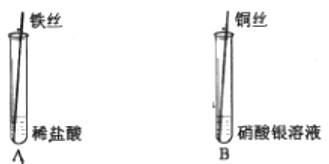
①A中观察到铁丝表面;
②B中发生反应的化学方程式为,该实验过程中可观察到的现象有
a.冒气泡
b.出现海绵状银白色固体
c.铜丝表面变黑
d.无色溶液变为蓝色
③为达到实验目的,还需补充一个实验(写成所需试剂化学式)。
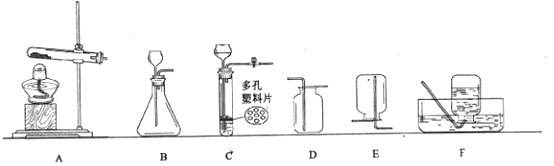
①用氯酸钾制取氧气,选择的发生装置是,发生反应的化学方程式为;
②实验室制取二氧化碳,若需控制反应的发生与停止,所选装置组合是,若制取0.01molCO2 , 需要mol碳酸钙与稀盐酸反应?(根据化学方程式计算)
③很多反应均能产生CO2 , 例如a.2NaHCO3 Na2CO3 + H2O +CO2↑
B.NH4HCO3 NH3↑ + H2O + CO2↑
在实验室制取CO2 , 以上两个反应哪个更合适?理由是;
甲 | 乙 | 丙 | |
实验操作 | 分别滴加酚酞试液
| 分别滴加溶液
| 分别滴加BaCl2溶液
|
现象与结论 | 呈色的是Na2CO3溶液,无色的是NaCl溶液 | 冒气泡的是Na2CO3溶液,无明显现象的是NaCl溶液 | 有的Na2CO3溶液,无明显现象的是NaCl溶液 |
丙同学实验后将两只试管中的物质倒入洁净烧杯,静置后取上层清液,滴加稀硫酸观察到 ,可知上层清液中含有BaCl2 , 为避免可溶性钡盐引起水体重金属污染,可向废液中加适量再排放。
A.碳酸钠溶液
B.硫酸钠溶液
C.硝酸银溶液
D.水
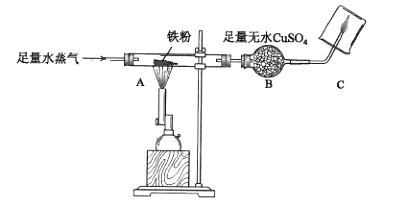
②实验停止后,同学们对玻璃管中黑色固体的成分进行探究。
【查阅资料】FeO和Fe3O4是常见的两种黑色含铁化合物;
FeO遇空气会立即变为红棕色
【进行实验】将黑色固体平铺与白纸上,试纸未见红棕色,可知黑色固体中不含。
经称量,黑色固体为5.8g。
(铁的氧化物均不与硫酸铜溶液反应)
|
实验操作 |
实验现象 |
实验结论 |
|
将黑色固体全部倒入烧杯并加入足量硫酸铜溶液。 |
|
黑色固体中不含铁粉 |
Ⅰ水蒸气与铁发生反应的化学方程式为,该反应(填“能”或“不能”)证明水是一种化合物。
Ⅱ利用本实验数据,列式表示黑色固体中铁、氧原子的物质的量之比(不要求计算)。