实验:利用Cu、Fe、Mg和不同浓度的硫酸溶液(0.5 mol/L、2 mol/L、18.4 mol/L),设计实验方案来研究影响反应速率的因素。
甲同学的实验报告如表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积的2 mol/L硫酸溶液于三支试管中 ② |
反应速率:Fe>Cu,Cu不反应 |
金属的性质越活泼,反应速率越快 |
甲同学表中的实验步骤②为。

如图所示,装置气密性良好,且1000 mL量筒中已充满了水,实验开始时,先用导线连接a、b,然后先将金属片(填“a”或“b”)插入溶液中。
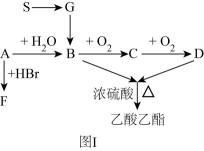

请回答下列问题:
G的名称是,B的官能团名称为,F的结构简式为。
a.含75%的B溶液可用于杀菌消毒
b.钠与B反应生成 , 反应时钠块浮在B的上面
c.在酒精灯上灼烧后的铜丝立即插入B中,铜丝又变回亮红色
某化学小组设计实验探究乙酸乙酯在不同温度、不同浓度稀硫酸中的水解速率。取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。
编号 | ① | ② | ③ |
温度/℃ | 50 | 50 | 75 |
乙酸乙酯/mL | 3 | ||
稀 | 3 | 2 | 3 |
蒸馏水/mL | 0 | 0 |
回答下列问题:
请完成上表,其中,
。

①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是(写化学式)。
③再经过一段时间观察到装置N中溶液变成蓝色,装置N中溶液变成蓝色的原因是。
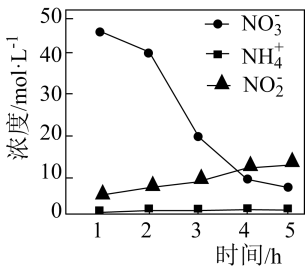
①Fe去除水中的NO 的机理:NO
得到纳米铁粉失去的电子转化为NO
, 极少量NO
在纳米铁粉或Cu表面得到电子转化为NH
。与不添加少量铜粉相比,添加少量铜粉时去除NO
效率更高,主要原因是。
②与初始溶液中NO浓度相比,反应后溶液中所有含氮物质(NO
、NO
、NH
)总浓度减小,原因是。
实验 编号 | 所加试剂及用量/mL | 条件 | 溶液颜色褪至无色所需时间/min | |||
0.01mol·L-1 H2C2O4溶液 | 0.01mol·L-1 KMnO4溶液 | 3.0mol·L-1 稀H2SO4 | 水 | 温度/℃ | ||
1 | 8.0 | 2.0 | 2.0 | 3.0 | 20 | t1 |
2 | 6.0 | 2.0 | 2.0 | 5.0 | 20 | t2 |
3 | 6.0 | 2.0 | 2.0 | 5.0 | 30 | t3 |
4 | 5.0 | 2.0 | 2.0 | 5.0 | 30 | t4 |
对比实验,可探究浓度对反应速率的影响;对比实验可探究温度对反应速率的影响。实验测得t3<t2 , 由此得出的结论是。


盛装KMnO4溶液应选用滴定管,判断达到滴定终点的现象为;根据题给数据,测得该乳酸钙产品的纯度为(保留三位有效数字)。

|
序号 |
V(过氧化氢溶液)/mL |
V(氯化铁溶液)/mL |
二氧化锰质量/g |
反应温度/℃ |
V(水)/mL |
结论 |
|
1 |
10 |
2 |
0 |
50 |
8 |
|
|
2 |
10 |
2 |
0 |
30 |
8 |
|
|
3 |
10 |
0 |
1 |
30 |
a |
①实验1、2研究的是对 分解速率的影响。
②表中数据a的值应该为;实验2、3研究的是对 分解速率的影响。
③如果实验3中30s时共收集到气体的体积为11.2mL(已折算成标准状况下),则用过氧化氢表示的0~30s的平均反应速率为 。
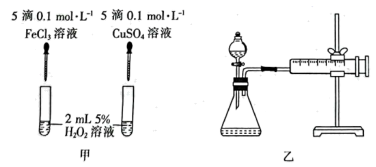
①甲装置:通过观察气泡产生的速率,比较二者的催化效果。但小组某同学提出将硫酸铜改为氯化铜更好,其理由可能是。
②通过乙装置也能比较二者的催化效果。同温同压下,均以生成40mL气体为准,其他可能影响实验的因素均已忽略。则实验中还需要测量的数据是。
|
时间/min |
1 |
2 |
3 |
4 |
5 |
|
氢气体积/mL |
50 |
120 |
232 |
290 |
310 |
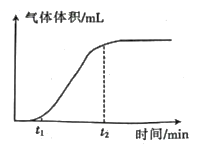
①在0~1、1~2、 2~3、3-4、4~-5min各时间段中:
反应速率最大的时间段是 min,主要的原因可能是。
反应速率最小的时间段是 min,主要的原因可能是。
②为了减缓反应速率但不减少产生氢气的量,可以在稀硫酸中加入(填序号)。
a Na2CO3溶液 b NaOH溶液 c 稀HNO3 d 蒸馏水
实验I:

实验II:另取两支试管分别加入5 mL5%H2O2溶液和5mL10%H2O2溶液,均未观察到有明显的气泡产生。
①双氧水分解的化学方程式是。
②实验I的目的是。
③实验II未观察到预期现象,为了达到该实验的目的,可采取的改进措施是。
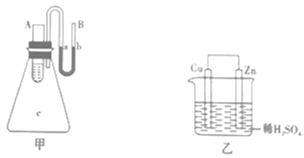
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子的流动方向,从Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生H2为0.5mol;
⑥正极的电极反应式为Zn-2e-=Zn2+。
以上描述合理的是(填序号)。
①若图乙的烧杯中最初装入的是500mL2mol·L-1的稀硫酸,当原电池工作2min时共收集到11.2L氢气(标准状况),则这2min内H2SO4的反应速率v(H2SO4)=。2min末,烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=、c(ZnSO4)=。
②若要使反应Zn+H2SO4=ZnSO4+H2↑的速率加快,下列措施可行的是(填序号)。
a.改锌片为锌粉
b.改稀H2SO4为98%的浓硫酸
c.升高温度
d.滴加少量CuSO4溶液
|
实验编号 |
金属 |
形态 |
反应温度/℃ |
收集 100 mL 氢气所需时间/s |
|
Ⅰ |
锌 |
薄片 |
15 |
200 |
|
Ⅱ |
锌 |
薄片 |
25 |
90 |
|
Ⅲ |
锌 |
粉末 |
a |
10 |
|
IV |
镁 |
薄片 |
25 |
42 |
SO2(g)+2OH-(aq) =SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq) =SO42-(aq)+Cl-(aq) ΔH2
CaSO4(s)=Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO-(aq) +2OH-(aq) = CaSO4(s) +H2O(l) +Cl-(aq)的ΔH=。

①实验时放出气体的总体积是。
②放出一半气体所需的时间为。
③反应放出 体积气体所需的时间约为。
④A , B , C , D各点反应速率的快慢顺序为。
⑤解释反应速率变化的原因:。
⑥H2O2初始状态的浓度为。
①该反应为(填“放热”或“吸热”)反应,因此在该反应中,断裂化学键吸收的能(填“大于”或“小于”)形成化学键放出的能量。
②下列措施中,能加快氢气生成速率的是(填字母)。
a.将铁片改成铁粉
b.降低稀H2SO4的温度
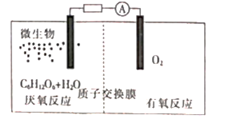
①有氧反应一极是电池的(填“正”或“负”)极,质子交换膜允许 通过,该电池的正极反应式为
②若该电路中转移电子的物质的量为12 mol,则生成CO2的体积(标准状况)为

该反应为反应(填“吸热”或“放热”)。
①加H2O ②加入几滴1mol/LHNO3溶液 ③滴入几滴浓盐酸
④加入一定量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液
⑦适当升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
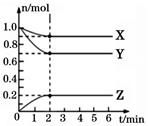
分析有关数据,写出X、Y、Z的反应方程式。

①实验1中,在10~20 min内,以物质Y表示的平均反应速率为mol/(L·min) ,50min时,实验3中Z的浓度。
②0~20min内,其它条件一样实验2 和实验1的反应速率不同,其原因可能是;实验3 和实验1的反应速率不同,其原因是。
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及部分记录)

请回答:

①该小组同学提出的假设是。
②请你帮助该小组同学完成实验方案,并填写表所加固体的化学式。

③若该小组同学提出的假设成立,t的大小范围是。
|
实验编号 |
盐酸浓度/(mol/L) |
铁的形态 |
温度/K |
|
① |
4.00 |
块状 |
293 |
|
② |
4.00 |
粉末 |
293 |
|
③ |
2.00 |
块状 |
293 |
|
④ |
2.00 |
粉末 |
313 |
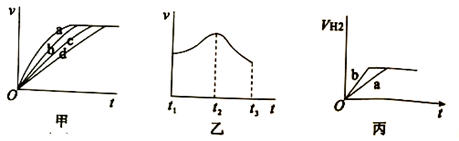
①其中t1~t2速率变化的主要原因是。
②t2~t3速率变化的主要原因是 。
|
实验 |
操作 |
现象 |
|
I |
常温下将MnO2和12 mol·L-1浓盐酸混合 |
溶液呈浅棕色,略有刺激性气味 |
|
II |
将I中混合物过滤,加热滤液 |
生成大量黄绿色气体 |
|
III |
加热MnO2和4 mol·L-1稀盐酸混合物 |
无明显现象 |
①已知MnO2呈弱碱性。I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是。
②II中发生了分解反应,反应的化学方程式是。
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV进行探究:
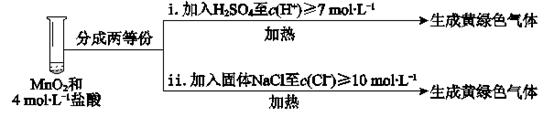
将实验III、IV作对比,得出的结论是;将i、ii作对比,得出的结论是。
|
实验(20oC) |
现象 |
|
Ⅰ.过量铜粉、2 mL 0.5 mol/L HNO3 |
无色气体(遇空气变红棕色),溶液变为蓝色 |
|
Ⅱ.过量铁粉、2 mL 0.5 mol/L HNO3 |
6 mL无色气体(经检测为H2),溶液几乎无色 |
① 甲同学认为该浓度的硝酸中H+的氧化性大于NO3- , 所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法错误,其实验证据是。
② 乙同学通过分析,推测出NO3-也能被还原,依据是,进而他通过实证实该溶液中含有NH4+ , 其实验操作是。

研究小组在设计方案时,考虑了浓度、、因素对过氧化氢分解速率的影响。


图1 图2
①可通过观察,比较得出结论。
②有同学提出将0.1 mol·L-1FeCl3溶液改为0.05 mol·L-1Fe2(SO4)3更为合理,其理由是。
猜想 1:真正催化分解H2O2的是FeCl3溶液中的 Fe3+。
猜想 2:真正催化分解H2O2的是。
完成表格验证猜想:
|
所需试剂 |
操作及现象 |
结论 |
|
|
|
Cl-对H2O2分解无催化作用 |
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
