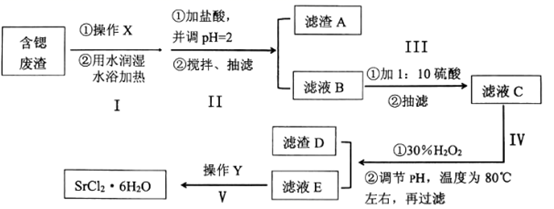
已知:①SrSO4微溶于水;
②SrCl2•6H2O在61.5℃以上即会失去4个结晶水生成SrCl2•2H2O。
|
硫酸加入量/mL |
4.50 |
4.95 |
5.40 |
5.85 |
6.30 |
|
Ba2+/(g/L) |
0.37 |
0.21 |
0.13 |
0.11 |
0.10 |
|
Sr2+/(g/L) |
90.21 |
89.86 |
89.57 |
89.23 |
88.90 |
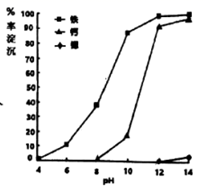
②往滤渣D中加入NaClO溶液,发生反应的离子方程式为:。
滤液E→()→()→()→抽滤→()→()
a.蒸发浓缩至有大量晶体析出
b.在过饱和溶液中加入晶种
c.6l.5℃以上减压蒸发浓缩
d.6l.5℃以下减压蒸发浓缩
e.往溶液中加入无水乙醇
f.在30℃真空烘箱中干燥
g.在室温下缓慢冷却结晶
h.用氯化锶饱和溶液洗涤晶体
I.用冷水洗涤晶体
①判断滴定终点的现象为;
②实验时未采用棕色滴定管滴定,会使测得的晶体纯度(填“偏高”、“偏低”或“不变”)。