1.
(2021·咸阳模拟)
铈是稀土中丰度最高的元素,其在电子材料、催化剂等方面的应用广泛。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈(CeO2),并测定其纯度。其工艺流程如下:

已知:①稀土离子易和SO  形成复盐沉淀:
形成复盐沉淀:
Ce2(SO4)3+Na2SO4+nH2O= Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
②硫脲:一种有机物,结构简式为 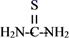 ,酸性条件下易被氧化为(SCN2H3)2;
,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
-
-
-
(2)
CeFCO3中Ce元素的化合价为,滤渣A的主要成分是
-
-
(3)
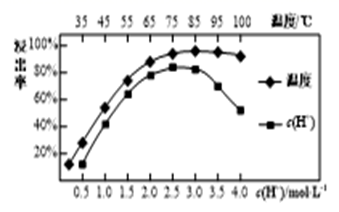
焙烧后加入硫酸浸出,稀土的浸出率和硫酸浓度、温度有关,如图所示,应选择的适宜的条件为
,硫酸浓度过大时,浸出率减小的原因是
。
-
-
(4)
加入硫脲的目的是将Ce4+还原为Ce3+ , 反应的化学方程式为。
-
-
(5)
步骤③加入盐酸后,通常还需加入H2O2 , 其主要目的为。
-
-
-
-
(7)
取所得产品CeO2 8.0g,用30 mL高氯酸和20 mL磷酸混合液加热溶解,冷却至室温后,配成250 mL溶液。取25.00 mL溶液用0.2000 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,已知滴定时发生的反应为Fe2++Ce4+=Fe3++Ce3+ , 达到滴定终点时消耗硫酸亚铁铵溶液20.50 mL,则该产品的纯度为。
-

形成复盐沉淀:
![]() ,酸性条件下易被氧化为(SCN2H3)2;
,酸性条件下易被氧化为(SCN2H3)2;