
已知:As与P同为VA族元素;Ca3(AsO3)2微溶于水,Ca3(AsO4)2难溶于水。
下列说法错误的是( )

下列说法错误的是( )
 B .
B .  C .
C .  D .
D . 


已知:Be(OH)2具有两性,在强碱性溶液中可转化为BeO
下列说法错误的是( )
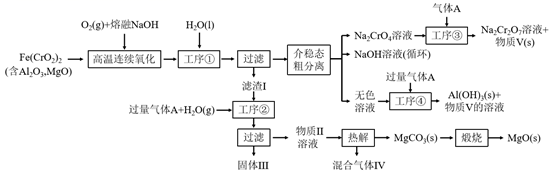
回答下列问题:
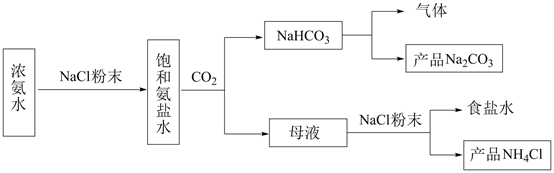
回答下列问题:
A. 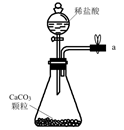 B.
B. 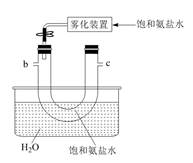 C.
C.  D.
D. 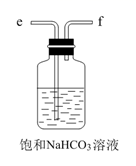 E.
E. 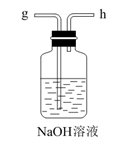
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2 , Na2O2增重0.14g,则固体NaHCO3的质量为g。
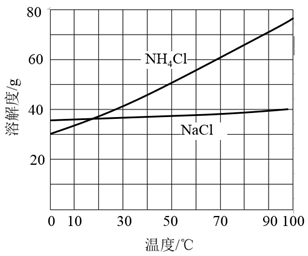
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为、、洗涤、干燥。

该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表:
|
金属离子 |
|
|
|
|
|
开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
|
沉淀完全(c=1.0×10*mol-L')的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:
ⅰ.
ⅱ.
产物产率与反应温度、反应后溶液pH关系如下表。
| 反应温度/℃ | 反应终液pH值 | 2PbCO3·Pb(OH)2产率/% |
| 70 | 4.35 | 0 |
| 85 | 4.67 | 47.8 |
| 95 | 5.90 | 83.4 |
| 105 | 5.36 | 86.6 |
①85℃时,产物中PbCO3含量高于2PbCO3·Pb(OH)2是因为尿素水解速率(填“大于”或“小于”) CO 结合Pb2+速率。
②85~95℃,升高温度,2PbCO3·Pb(OH)2产率增加的原因为。

已知:镍的萃取、反萃过程反应为
|
电解电压(V) |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
|
Fe2+ |
有 |
有 |
有 |
无 |
无 |
|
Cr4+ |
无 |
无 |
无 |
无 |
有 |
|
电解时间(h) |
2.6 |
3.1 |
3.6 |
4.1 |
4.6 |
|
Fe2+ |
有 |
无 |
无 |
无 |
无 |
|
Cr4+ |
无 |
无 |
有 |
有 |
有 |

已知:①氧化性:Co3+>Cl2>H2O2>Fe3+。
②“酸浸”后溶液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等。
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(当离子浓度不大于10-5 mol/L 时,认为该离子沉淀完全):
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
②“滤液”中加入萃取剂的作用是。
查阅资料得:实验室制取甲烷常用的方法为无水醋酸钠(CH3COONa)与氢氧化钠在二氧化锰作催化剂的条件下共热,产物中有少量的副产物丙酮(CH3COCH3),丙酮可与水混溶。

A. K1关闭、K2关闭
B. K1关闭、K2打开
C.K1打开、K2打开
D.K1打开、K2关闭
|
装置 |
D |
E |
F |
G |
|
实验前装置总质量/g |
180.0 |
277.8 |
311.5 |
301.0 。 |
|
实验后装置总质量/g |
177.2 |
279.6 |
312.6 |
301.0 |
若装置D中的氧化铜全部被还原成铜,则气球中收集到的由D中反应产生的气体在标准状况下的体积为L,此条件下,装置D中发生反应的化学方程式为。

已知:①还原性:
② 和
结合生成较稳定的
,强酸性条件下分解生成
回答下列问题:

 +2NaClO(浓)
+2NaClO(浓)
 +2NaOH+H2O
+2NaOH+H2O
实验步骤如下:
从进料口加入10mL 30% NaOH溶液,在10℃左右水浴,搅拌条件下通入Cl2至溶液pH约为8;再加入10mL 40% NaOH溶液,继续通入Cl2至溶液pH约为8。
用烧碱固体配制40%的NaOH溶液,下列仪器中不需要的是(写名称)。




待步骤Ⅰ结束后,从进料口加入氰尿酸,在搅拌状态下继续通入Cl2 , 在10℃左右下反应30min,此时三颈瓶内有DCCNa白色晶体析出,停止反应。
为了使晶体充分析出并分离,需要的操作为、洗涤、干燥。
称取0.1000g样品,用100mL蒸馏水于碘量瓶中溶解后,依次加入20mL 0.3mol·L-1醋酸溶液和过量的KI溶液。用0.1000 mol·L-1 Na2S2O3溶液滴定至溶液呈浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液16.00mL。
(已知: 

,
)
滴定终点的现象为。
 已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
| 溶液pH | <4.0 | 6.0—8.0 | 8.0—10.0 |
| 钒元素主要存在形式 | | | |
请回答下列问题:

A.用热空气吹出
B.用CCl4萃取
C.用SO2将其还原吸收
D.只需经过蒸馏等物理变化
 已知:
已知: 是一种极弱的酸,可溶于水、乙醇;
易溶于水,微溶于乙醇;相关物质的溶解度随温度变化如图。

请回答:
 a.减压蒸发溶剂;
a.减压蒸发溶剂;
b.加压蒸发溶剂;
c.用布氏漏斗抽滤;
d.用普通漏斗过滤;
e.蒸发至溶液出现晶膜,停止加热;
f.蒸发至溶液中出现大量晶体,停止加热;
g.冷水洗涤;
h.乙醇洗涤;
i.冷却至室温。
已知:i. 与NaOH溶液发生的反应为:
ii. 与甘露醇等多羟基化合物形成稳定的络合物,增大其电离度。
2  +
+
 +H++3H2O
+H++3H2O
① 不能直接用NaOH溶液滴定的原因是。
② 的纯度为(用含字母的式子表示)。

已知:NaClO2饱和溶液在低于38℃时会析出NaClO•3H2O,高于38℃时析出NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl。
试回答下列问题:

a.趁热过滤 b.50℃水洗涤 c.加热蒸发结晶 d.冰水洗涤 e.55℃恒温减压蒸发结晶

已知:常温下,Ksp(MnS)=1×10-11.金属离子生成氢氧化物沉淀的pH如下表:
| 金属离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.6 | 9.6 |
| 完全沉淀 | 2.8 | 8.3 | 10.2 | 11.6. |
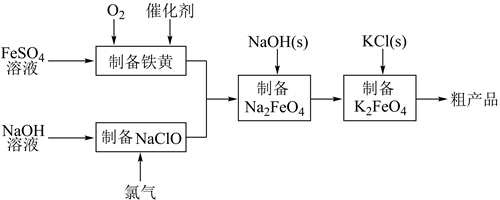
回答下列问题:


已知:①稀土离子易和SO 形成复盐沉淀:
Ce2(SO4)3+Na2SO4+nH2O= Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
②硫脲:一种有机物,结构简式为 ![]() ,酸性条件下易被氧化为(SCN2H3)2;
,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
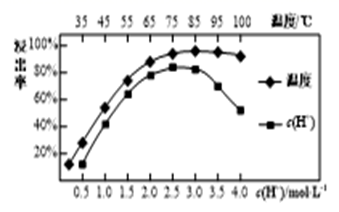

I.查阅资料:
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl。
Ⅱ.制备与分离:
①减压,55℃蒸发结晶; ②;
③用38℃~60℃热水洗涤; ④在38℃~60℃间进行干燥,得到成品。
利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.4450g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4 , 再滴加几滴淀粉溶液,(已知:ClO +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
=S4O
+2I-)。
①滴定终点的现象是。
②下列滴定操作会导致测量结果偏低的是(填字母)。
a 锥形瓶洗涤后没有干燥 b 滴定时锥形瓶中有液体溅出
c 滴定终点时俯视读数 d 滴定管滴定前有气泡,滴定后气泡消失
③样品中NaClO2·3H2O的纯度为%(用含c、v的代数式表示)。

已知:①Ka1(H2C2O4)=6.0×10-2;Ka2(H2C2O4)=6.25×10-5。
②25℃时,各物质的溶度积常数如表:
| Ksp[Fe(OH)3] | Ksp(PbSO4) | Ksp(PbC2O4) |
| 2.5×10-39 | 2.0×10-8 | 5.0×10-10 |
回答下列问题:

溶液中金属离子开始沉淀和完全沉淀的pH如表所示,回答下列问题:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时的pH | 6.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时的pH | 8.7 | 4.7 | 3.2 | 9.0 |

25℃时,相关物质的Ksp见表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | CuCl |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-19.7 | 1×10-5.9 |
回答下列问题:

①称取样品3.0 g于锥形瓶中,再加入过量的FeCl3溶液充分溶解,配制250 mL溶液。②从中取出25.00mL溶液,用0.1000 mol·L-1硫酸铈[Ce(SO4)2]标准溶液滴定。已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+。
三次平行实验,到达滴定终点时,消耗硫酸铈标准溶液的体积分别为26.05 mL、24.05 mL、23.95 mL。则样品中CuCl的纯度为(结果保留三位有效数字)。

查阅资料:①3NaClO 2NaCl+NaClO3;②N2H4·H2O易溶于水,熔点-40℃,沸点为118℃,具有强还原性,能与NaClO剧烈反应生成N2;属于二元弱碱,在空气中可吸收CO2而产生烟雾。

回答下列问题:
盛装浓盐酸仪器的名称是,加入实验药品之前必须进行的操作是。

装置中的直形冷凝管(填“能”或“不能”)用球形冷凝管代替。

已知:
Ⅰ.乙胺是无色极易挥发的液体,结构简式为CH3CH2NH2 , 呈碱性,与酸发生反应:CH3CH2NH2+H+=CH3CH2NH
Ⅱ.酸性条件下,Na2WO4与乙胺“萃取”发生反应:2CH3CH2NH +WO
(CH3CH2NH3)2WO4
Ⅲ.TiOSO4易溶于水,属于强电解质;偏钛酸难溶于水,其化学式可表示为H2TiO3或TiO(OH)2 , 室温时,Ksp[TiO(OH)2]=1.0×10-27。
回答下列问题:


已知:Ⅰ.“反应”过程中 发生的转化为:NO
+H++
 ⇌
⇌  +H2O,3
+H2O,3  +Co3+⇌3H++
+Co3+⇌3H++  ↓
↓
Ⅱ.烧渣中含有 、
、
、
、
;滤渣的成分为
、
。
回答下列问题:

仪器a的名称为。
②石英管直接伸入收集装置,该管较粗,其优点是。
将铝片放入盛有0.1mol·L-1CuCl2溶液的试管中,观察到现象为:铝片表面析出疏松的紫红色固体,产生无色无味气体,溶液颜色变浅。
紫红色固体为(填化学式)。
|
猜测 |
实验 |
现象 |
结论 |
|
i.①。 |
取少量Cu(OH)2悬浊液,加入打磨过的铝片,振荡 |
无明显现象 |
猜想i不成立 |
|
ii.Cu(OH)2与Al3+发生了反应 |
②。 |
固体立即溶解,溶液呈浅绿色 |
猜想ii成立 |
③在猜测ii成立的基础上,该小组成员查阅文献发现体系中可能存在反应:2Al3++3Cu(OH)2=2Al(OH)3+3Cu2+ , 列式计算平衡常数分析该反应进行的趋势。(已知:Ksp[Cu(OH)2]=2.2×10-20;Ksp[Al(OH)3]=1.3×10-33。一般认为,K>105时反应进行较完全,K<10-5时反应难以进行)文献显示生成的Al(OH)3可能以胶体形式存在,这是未观察到白色沉淀的可能原因,但仍需进一步深入研究。