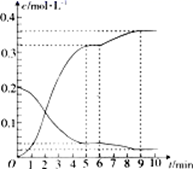
0~5min内,用H2(g)表示的该反应速率v(H2)=。6min时,改变的外界条件为。
第一步:I2 2I(快速平衡);
第二步:I+H2 H2I(快速平衡);
第三步:H2I+I→2HI(慢反应)。
则该反应的反应速率由步决定。
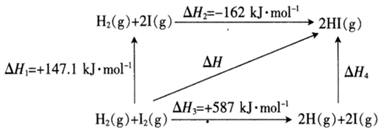
①I2(g) 2I(g)Kpl=200ΔH1
②I2(g)+H2(g) 2HI(g)Kp2ΔH2
KP为以分压表示的平衡常数。1500K时,平衡体系中I(g)的分压为kPa,Kp2=(写表达式)。
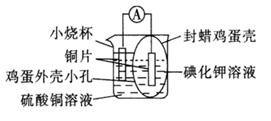
带孔的封蜡鸡蛋壳为半透膜,鸡蛋壳内的电极为(填“正极”或“负极”);该电极反应式为。