下列叙述错误的是
|
选项 |
实验操作及现象 |
结论 |
|
|
常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 |
稀硝酸的氧化性比浓硝酸强 |
|
|
取一定量 |
此样品中含有 |
|
|
将银和 |
|
|
|
向溴水中加入苯,振荡后静置,水层颜色变浅 |
溴与苯发生了加成反应 |


下列说法错误的是( )



Li极催化剂 | 碳化钼(Mo2C) | Au和多孔碳 |
CO2的放电产物 | 草酸锂(Li2C2O4) | Li2CO3和C |


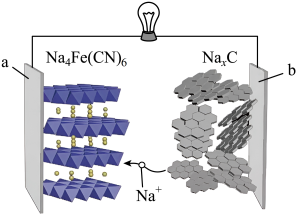
 )作为燃料的燃料电池研究中取得新进展,合成了负载在炭黑上的铂与硫化镍纳米颗粒双功能催化剂(PtNiSx/CB),实现了在输出能量的同时将燃料转变为更高价值的产品。反应装置如图1所示,反应时间和负极产品百分含量关系如图2所示,下列说法正确的是
)作为燃料的燃料电池研究中取得新进展,合成了负载在炭黑上的铂与硫化镍纳米颗粒双功能催化剂(PtNiSx/CB),实现了在输出能量的同时将燃料转变为更高价值的产品。反应装置如图1所示,反应时间和负极产品百分含量关系如图2所示,下列说法正确的是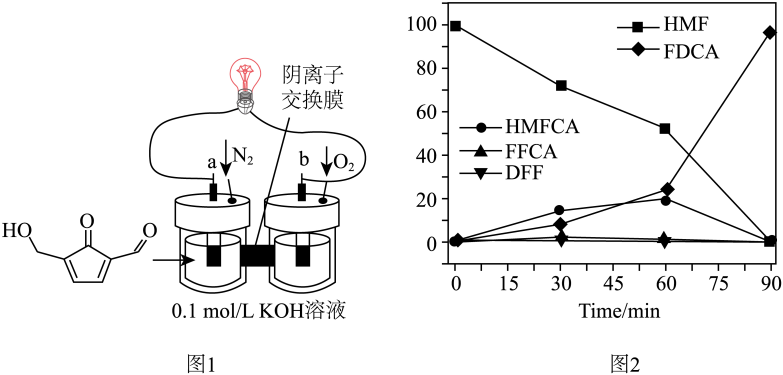
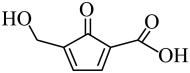 )的电极反应式为
)的电极反应式为 -e—+OH—=
-e—+OH—=  +H2O
C . OH—由左池进入右池
D . 制备FDCA需要燃料电池工作60min以上
+H2O
C . OH—由左池进入右池
D . 制备FDCA需要燃料电池工作60min以上


 同时生成1mol
同时生成1mol


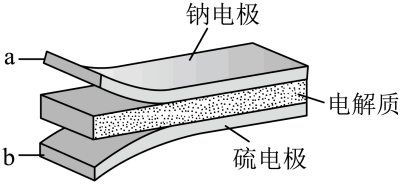
(电池总反应为: )


|
化合物 |
TiF4 |
TiCl4 |
TiBr4 |
TiI4 |
|
熔点/℃ |
377 |
﹣24.12 |
38.3 |
155 |



i、ii中涉及到的分离操作是。
已知:温度相同时,溶解度s[Ca(OH)2]<s(CaSO4)
①平衡移动的角度解释HA在i中反应起到的作用:。
②本流程中还利用了HA的性质是。

产生OH-的电极反应是,NaOH在(填“A”或“C”)区生成。

①欲验证铁电极发生氧化反应的产物,实验操作和现象是。
②分别用化学用语表示Fe和Cu表面均产生无色气泡的原因:;。

①铜与浓硝酸反应的离子方程式为。
②闭合开关K后,将铁电极快速插入浓硝酸中,观察到指针快速向右偏转的原因是(结合铜电极反应式说明)。
③电流表指针向左偏转后,示数几乎不变的原因之一是铁电极上氧化膜放电,但氧化膜的生成速率大于(或等于)氧化膜的消耗速率。请设计实验方案证明:。

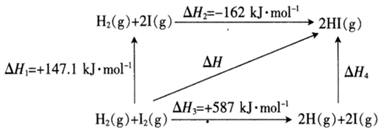
则ΔH=(用ΔH1和ΔH2表示)。


该电池正极的电极反应式为。

已知:Cr(OH)3受热易分解。
回答下列问题:

{已如Ksp[Fe(OH)3]=2.8×10-39 , Ksp[Cr(OH)3]=5.6×10-31}

①上述反应的能量变化如图所示,则ΔH=kJ·mol-1。

②某温度下,等物质的量的C2H6和CO2在刚性容器内发生上述反应,tmin时达到平衡。已知起始总压为akPa,平衡时总压为bkPa,0~tmin的平均反应速率为v(CO2)=kPa·min-1 , 该反应的平衡常数Kp=(用含a、b的代数式表示),欲提高CO2的平衡转化率,可采取的措施有(填标号)。
A.通入惰性气体 B.增加C2H6浓度 C.增加CO2浓度 D.降低温度
③2000年,我国学者研究CeO2催化上述反应的过程为:
(i)2CeO2+C2H6=Ce2O3+C2H4+H2O
(ii)(写出化学方程式)。

①阳极的电极反应式为。
②标准状况下,若消耗2.24LCO2 , 转移电子个数为。

通入CO2气体的一极为(填“阴极”、“阳极”、“正极”或“负极”),写出该极的电极反应式:。


①下列说法正确的是(填标号)。
a.相同条件下,的碱性比
强
b.当时,一定达到了化学平衡状态
c.A点和C点化学平衡常数的关系是:
d.温度一定时,达平衡后再充入氨气,的体积分数减小
②气相平衡中用组分的平衡分压代替物质的量浓度也可以表示平衡常数(记作Kp),已知在T1℃时体系的压强初始压强为a Pa,则B点的Kp= Pa(用含a表示且保留2位有效数字)。

①M为电源的极,电解过程中阳极产生的离子迁移到达阴极并在阴极析出高纯镓。请写出电解过程的阴极的电极反应。
②电解过程中需控制合适的电压,电压太高会导致阴极电解效率下降,其可能的原因是。若外电路通过0.25mol e-时,阴极得到3.5g的镓。则该电解装置的电解效率(
生成目标产物消耗的电子数/转移的电子总数)
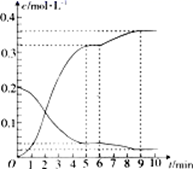
0~5min内,用H2(g)表示的该反应速率v(H2)=。6min时,改变的外界条件为。
第一步:I2 2I(快速平衡);
第二步:I+H2 H2I(快速平衡);
第三步:H2I+I→2HI(慢反应)。
则该反应的反应速率由步决定。
①I2(g) 2I(g)Kpl=200ΔH1
②I2(g)+H2(g) 2HI(g)Kp2ΔH2
KP为以分压表示的平衡常数。1500K时,平衡体系中I(g)的分压为kPa,Kp2=(写表达式)。
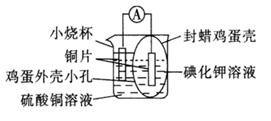
带孔的封蜡鸡蛋壳为半透膜,鸡蛋壳内的电极为(填“正极”或“负极”);该电极反应式为。

a.普通玻璃坩埚 b.石英坩埚 c.陶瓷坩埚 d.铁坩埚
a.双氧水 b.84消液(NaClO溶液) c.75%酒精

| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| | 92 | 95 | 97 | 93 | 88 |
分析40℃时 转化率最高的原因。

方案一:V2O5 VCl2溶液
方案二:在800℃的N2流中VCl3分解

请回答下列问题:
①按气流方向,上述装置合理的连接顺序为A→(用大写字母填空)。
②焦性没食子酸溶液的作用是。
③实验过程中需持续通入空气,其作用为。
④实验后,选用D中所得溶液和其他合理试剂,设计实验方案证明C处有Cl2生成。
①滴定终点的现象为。
②产品中VCl2的物质的量分数为。(保留3位有效数字)

①
②
③
则表示 燃烧热的热化学方程式为。
I. II.
其反应过程能量变化如图所示

①决定NO氧化反应速率的步骤是(填“I”或“II”),其理由是。
②一定温度下,在刚性密闭容器中,起始充入一定量的 气体(
转化为
忽略不计),此时压强为36kPa,在5min达到平衡,此时容器的压强为46kPa,则0~5min用
的分压表示反应速率为。该温度下,此反应的平衡常数
(
是平衡分压代替平衡浓度计算的平衡常数)。
③恒温恒容条件下,能说明该反应达到平衡状态的是(填字母)。
A.压强不再变化
B.混合气体的密度不再变化
C.生成NO的速率与消耗 的速率相等
D.混合气体的平均相对分子质量不再变化

①2Al2O3(s) 4Al(s)+3O2(g) △H1= +3351.4 kJ·mol - 1
②C(s)+O2(g)=CO2(g) △H2= -393.5 kJ·mol - 1
③C(s)+CO2(g)=2CO(g) △H3=+172.5 kJ·mol - 1
④3C(s)+Al2O3(s) 2Al(s)+3CO(g) △H4
则△H4= kJ·mol- 1。
⑤Al2O3(s)
+3C(s)+ AlCl3(g) 3AlCl(g)+ 3CO(g) △H5
⑥3AlCl(g) 2Al(l)+AlCl3(g) △H6
反应⑤、反应⑥中吉布斯自由能(△G)与温度(T)的变化关系如图1所示,由此判断反应⑤对应图中的曲线(填“I”或“II”),试分析氧化铝碳热还原氯化法炼铝的可行性:。

①650℃反应达到平衡时,容器体积为10 L,则平衡时c(CO)=。
②T℃时,若向平衡体系中再充入一定量n(CO):n(CO2)=2:3的混合气体,则平衡(填“向正反应方向”、“向逆反应方向”或“不”)移动。
③800℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= [用含p总的代数式表示,气体分压(p分)=气体总压(p总)×体积分数]。
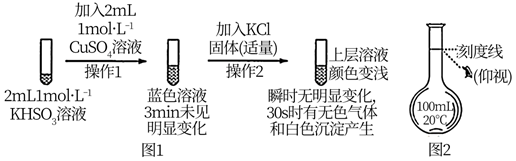
已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水
回答下列问题:

①K闭合时,一段时间后指针几乎归零。
②向U型管右管添加,a电极为极,产生的现象证实了其推测,其中不同于图1操作2后的现象是。