已知:2H2O(l)=2H2(g)+O2(g) △H1=+571.0kJ•mol-1
2Fe3O4(s)=6FeO(s)+O2(g) △H2=+313.2kJ•mol-1
则3FeO(s)+H2O(1)=H2(g)+Fe3O4(s) △H3=kJ•mol-1
①研究表明上述反应历程分两步:
Ⅰ.2NO(g)+H2(g) N2(g)+H2O2(1)(慢反应)
Ⅱ.H2O2(1)+H2(g) 2H2O(g)(快反应)
该总反应的速率由反应(填“Ⅰ”或“Ⅱ”)决定,反应Ⅰ的活化能比反应Ⅱ的活化能(填“高”或“低”)。
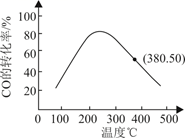
②该反应常伴有副产物N2O和NH3。以Pt作催化剂,用H2还原某废气中的NO(其他气体不反应),270℃时H2的体积分数对H2—NO反应的影响如图所示。随着H2体积分数的增大,N2的体积分数呈下降趋势,原因是。
| t/s | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/(mol/L) | 0.100 | 0.062 | 0.048 | 0.040 | 0.040 |
| c(NO2)/(mol/L) | 0 | 0.076 | 0.104 | 0.120 | 0.120 |
①0~40s,N2O4的平均反应速率为。
②反应达到平衡后再充入N2O4mol,才能使再次达到平衡时,NO2的浓度为0.24mol/L。