
下列说法错误的是( )
时间/s | 20 | 30 | 40 |
1.0 | 0.8 | ||
0.6 |
t/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 0 | 0.5 | 0.75 | 0.85 | 0.9 | 0.9 |
t/s | 0 | 20 | 40 | 60 | 80 |
n(N2O4)/mol | 0.100 | 0.062 | 0.048 | 0.040 | 0.040 |
n(NO2)/mol | 0 | 0.076 | 0.104 | 0.120 | 0.120 |
下列说法正确的是

实验编号 | 温度/℃ | 平衡常数/mol-1·L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法错误的是
|
|
|
|
“蒸粮”时加热 | “拌曲”前摊晾 | “堆酵”时升温 | “馏酒”时控温 |
时间/min c(NH3)/(×10-3mol•L-1) 催化剂 | 0 | 20 | 40 | 60 | 80 |
催化剂I | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
催化剂II | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
下列说法错误的是

已知:T℃时,该反应的化学平衡常数K=1。

| n(N2) | n(H2) | n(NH)3 |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
t/min | 0 | 10 | 20 | 30 | 40 | 70 | 90 |
c/(mol·L-1) | 0 | 0.04 | 0.07 | 0.09 | 0.10 | 0.12 | 0.12 |
关于该反应,下列说法正确的是( )
某温度下,在体积2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,经过2min达到平衡状态时CO2的转化率为50%。此过程中以CH4表示的平均化学反应速率为。平衡常数的值为。达到平衡后,其他条件不变时向容器中充入CO2与CO各1mol,则化学平衡移动(选填“正向”“逆向”或“不”)。
序号 | 加热温度/℃ | 反应物气体流量/L•min-1 | n(CH4)∶n(CO2) | α/% | η/% |
ⅰ | 700 | 4 | 2∶2 | 49.0 | 42.0 |
ⅱ | 800 | 4 | 2∶2 | 79.6 | 52.2 |
ⅲ | 800 | 6 | 3∶3 | 64.2 | 61.9 |
ⅳ | 800 | 6 | 2∶4 | 81.1 | 41.6 |
已知储能效率η=Qchem/Qi , 其中,Qchem是通过化学反应吸收的热量,Qi是设备的加热功率。
解释为何可以用CH4-CO2重整反应进行储能。
表1
物质 | HCHO(g) | H2(g) |
燃烧热(ΔH)/(kJ · mol-1) | -570. 8 | -285. 8 |
已知:H2O(g)=H2O(l) ΔH =-44 kJ ·mol-1。
CO2(g)+2H2(g) HCHO(g)+H2O(g) ΔH =kJ·mol-1
表2
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
φ(CO2) | 0.250 | 0.230 | 0.215 | 0.205 | 0.200 | 0.200 |
达到平衡时CO2的转化率为。
反应1:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1= +41.2kJ·mol-1
反应2:CO2(g) +3H2(g) CH3OH(g)+H2O(g) ΔH2<0。
在不同温度、压强下,测得相同时间内CO2的转化率如图1。0.1 MPa时,CO2的转化率在600 ℃之后随温度升高而增大的主要原因是 。


①起始时容器内气体的总压强为8p kPa,若10 min时反应到达c点,则0~10 min内,v(H2)=mol·L-1· min-1。
②b点时反应的平衡常数Kp= (用含 p的表达式表示)(kPa)-2。(已知:用气体分压计算的平衡常数为Kp,分压=总压×物质的量分数)


反应:
。
①分别在不同温度、不同催化剂下,保持其它初始条件不变,重复实验,经相同时间测得体积分数与温度的关系如图所示:

在催化剂甲作用下,图1中M点的速率(填“>”、“<”或“=”),根据图1所给信息,应选择的反应条件为。
②一定温度下,该反应正逆反应速率与、
的浓度关系:
,
(
、
是速率常数),且
或
的关系如图所示,向恒容密闭容器中充入一定量
, 反应进行m分钟后达平衡,测得
, 该温度下,平衡常数K=(用含a、b的计算式表示,下同),用
表示的平均反应速率为
。

①NaOH(aq)+H2S(g)=NaHS(aq)+H2O(1) ΔH1=xkJ·mol-1
②Na2S(aq)+H2S(g)=2NaHS(aq) ΔH2=ykJ·mol-1
2NaOH(aq)+H2S(g)=Na2S(aq)+2H2O(l) ΔH=kJ·mol-1(用含x、y的代数式表示)。
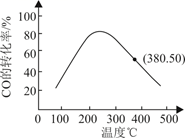
①分别选取Fe2O3、NiO作催化剂,其他条件相同,反应相同时间时SO2的转化率随反应温度的变化如图1所示。选择Fe2O3作催化剂,最适宜温度大约为℃;选择NiO作催化剂,m点后SO2的转化率降低的原因是。
②某温度下,保持总压强为72kPa,向密闭容器中充入一定量的CH4和SO2 , 发生上述反应,测定SO2的平衡转化率与投料比[]的关系如图2所示。

该温度下。上述反应的平衡常数Kp=kPa。(提示:Kp为用气体分压计算的平衡常数,气体分压=总压×物质的量分数)

①已知2SO2(g)+O2(g) =2SO3(g) ΔH =−198 kJ·mol−1。则反应2O3(g)=3O2(g)的 ΔH=kJ·mol−1。
②其他条件不变时,增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是。

①写出NO与ClO反应的离子方程式:。
②烟气中含有少量SO2 , 能提高NO的脱除率,可能原因是。
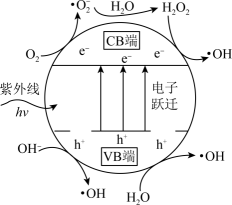
①TiO2光催化剂在紫外线作用下产生·OH的过程可描述为。
②在TiO2中掺杂一定量的金属离子可提高光催化活性。对所掺杂金属离子的要求是。
①能说明该反应已达平衡状态的是。
a.容器内固体质量保持不变 b.容器中气体压强保持不变
c.c(CO)=c(CO2) d.v正(CO)=v逆(CO2)
②若平衡后,保持温度不变,加入FeO后,c(CO2)将(填“增大”、“减小”或“不变”)。1100℃时K=0.263,测得高炉中c(CO2)=0.025mol•L-1、c(CO)=0.1mol•L-1 , 判断该反应是否处于平衡状态(填“是”、“否”),此时,化学反应速率是v正v逆(填“>”、“=”、“<”),其理由是。
请问答:
①在1100℃时,K=0.263,若此时测得高炉中 ,
, 判断反应速率
(正)
(逆),理由是。
②下列说法错误的是。
A.须采用高温高压的反应条件使FeO还原为
B.粉碎FeO能增大接触面积从而提高反应速率
C.平衡时提高CO气体的分压有利于提高Fe的产量
D.加入CaCO3(s)后因分解产生CO2必使平衡逆向移动
③高炉炉体结构如图1所示,以铁矿石、焦炭、石灰石和空气为原料,由图2推测炉腹中发生的主要反应是(选填:a、b、c、d)。

④若将体积比为1:1的CO和H2混合煤气通入进风口,测得不同温度下FeO还原到后,还原剂剩余的物质的量n值如下:
还原剂 | 600℃ | 700℃ | 800℃ | 900℃ | 1000℃ | 1100℃ | 1200℃ |
H2 | 4.18 | 3.34 | 2.94 | 2.60 | 2.32 | 2.30 | 2.25 |
CO | 1.66 | 2.50 | 2.90 | 3.24 | 3.52 | 3.54 | 3.59 |
请结合表格中的数据说明CO和H2分别还原FeO的倾向性大小是。
将原料气按n(CO2):n(H2)=1:4置于恒容密闭容器中发生反应1,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。

①请将a、b、c三点的逆反应速率va、vb、vc由大到小排序。
②在反应器中进行反应1,下列措施能提高CO2平衡转化率的是(填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
I.①已知:CO2(g)和H2O(g)的生成焓为:-394kJ/mol,-242kJ/mol。则∆H=kJ/mol。(生成焓是一定条件下,由其对应最稳定单质生成1mol化合物时的反应热。)
②若要反应2自发进行,(填“高温”或“低温”)更有利。
③反应2必须在高温下才能启动,原因是。
II.350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生反应2.若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如下表所示:
|
时间/min |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
压强 |
6.00P |
5.60P |
5.30P |
5.15P |
5.06P |
5.00P |
5.00P |
①350℃时反应2的Kp=(Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
②反应2的速率方程:v正=k正·c(CO2)·c2(H2),v逆=k逆·c2(H2O)(k是速率常数,只与温度有关)。30min时, c2(H2O)/[c(CO2)·c2(H2)](填“>”“<”或“=”);
③反应2的lg 、lg
随温度变化的曲线如图所示,则(填“m”或“n”)表示lg
随温度变化的曲线。

已知:2H2O(l)=2H2(g)+O2(g) △H1=+571.0kJ•mol-1
2Fe3O4(s)=6FeO(s)+O2(g) △H2=+313.2kJ•mol-1
则3FeO(s)+H2O(1)=H2(g)+Fe3O4(s) △H3=kJ•mol-1
①研究表明上述反应历程分两步:
Ⅰ.2NO(g)+H2(g) N2(g)+H2O2(1)(慢反应)
Ⅱ.H2O2(1)+H2(g) 2H2O(g)(快反应)
该总反应的速率由反应(填“Ⅰ”或“Ⅱ”)决定,反应Ⅰ的活化能比反应Ⅱ的活化能(填“高”或“低”)。
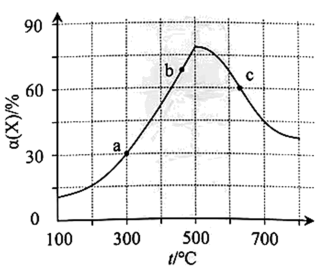
②该反应常伴有副产物N2O和NH3。以Pt作催化剂,用H2还原某废气中的NO(其他气体不反应),270℃时H2的体积分数对H2—NO反应的影响如图所示。随着H2体积分数的增大,N2的体积分数呈下降趋势,原因是。
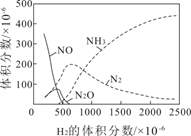
| t/s | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/(mol/L) | 0.100 | 0.062 | 0.048 | 0.040 | 0.040 |
| c(NO2)/(mol/L) | 0 | 0.076 | 0.104 | 0.120 | 0.120 |
①0~40s,N2O4的平均反应速率为。
②反应达到平衡后再充入N2O4mol,才能使再次达到平衡时,NO2的浓度为0.24mol/L。


①a、b、c、d四点的平衡常数从小到大的顺序为。
②若 ,反应达平衡时,
的体积分数为20%,则NO的转化率为。

①B、E两点对应的正反应速率大小为 (填“大于”、“小于”或“等于”)
。
②E、F、G、H四点对应气体的平均相对分子质量最大的点为。
| 反应机理 | 第一步反应 | 第二步反应 |
| ① | | |
| ② | | |