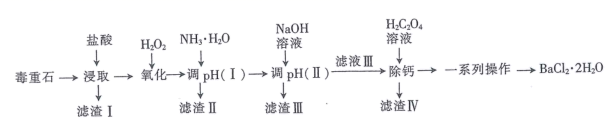
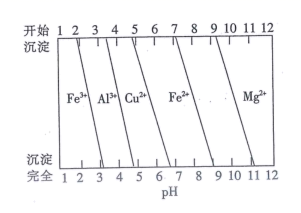
已知:盐酸“浸取”后,Ca、Mg、Fe、Al元素分别以Ca2+、Mg2+、Fe2+、Al3+形式存在于溶液中。
回答下列问题:
|
改变的条件 |
温度(℃) |
盐酸的浓度(%) |
液固比 |
||||||||||
|
30 |
55 |
75 |
10 |
15 |
20 |
25。 |
3:1 |
4:1 |
5:1 |
6:1 |
|||
|
钡的浸出率(%) |
74.31 |
69.60 |
68.42 |
59.21 |
74.31 |
74.15 |
55.32 |
59.84 |
65.12 |
74.31 |
74.35 |
||
分析表中数据,温度越高钡的浸出率越低的可能原因是;判断“浸取”的最佳液固比为。
①滴定至终点时的现象为。
②该溶液中钙离子的浓度为 (用含 V1、V2的代数式表示)g·mL-1。