|
选项 |
事实 |
解释 |
|
A |
甲苯能使酸性高锰酸钾溶液褪色,而烷烃不能 |
苯环活化了甲基 |
|
B |
|
水分子间可以形成氢键 |
|
C |
|
|
|
D |
|
甲基为推电子基,使乙酸羧基中的羟基的极性变小,电离程度比甲酸弱 |
 C .
C . 
选项 | 实验事实 | 理论解释 |
A |
|
|
B |
|
|
C | 酸性: |
|
D |
|
|
选项 | 实验事实 | 理论解释 |
A | 碘单质在苯中溶解度比在水中大 | 苯和 |
B | Be单质能溶于KOH溶液 | Be和Al在周期表中是对角线关系,性质相似 |
C | 稳定性:HF>HI | 非金属性:F>I |
D |
|
|
| 选项 | 实验事实 | 理论解释 |
| A | 碘单质在 CCl4 中溶解度比在水中大 | CCl4 和 I2 都是非极性分子, 而 H2O 是极性分子 |
| B | CO2 为直线形分子 | CO2 分子中 C═O 是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF 的沸点高于 HCl | HF 的相对分子质量小于 HCl |
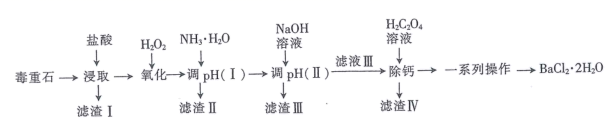
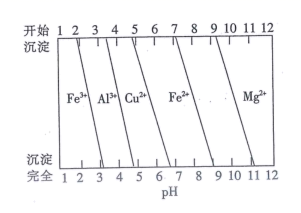
已知:盐酸“浸取”后,Ca、Mg、Fe、Al元素分别以Ca2+、Mg2+、Fe2+、Al3+形式存在于溶液中。
回答下列问题:
|
改变的条件 |
温度(℃) |
盐酸的浓度(%) |
液固比 |
||||||||||
|
30 |
55 |
75 |
10 |
15 |
20 |
25。 |
3:1 |
4:1 |
5:1 |
6:1 |
|||
|
钡的浸出率(%) |
74.31 |
69.60 |
68.42 |
59.21 |
74.31 |
74.15 |
55.32 |
59.84 |
65.12 |
74.31 |
74.35 |
||
分析表中数据,温度越高钡的浸出率越低的可能原因是;判断“浸取”的最佳液固比为。
①滴定至终点时的现象为。
②该溶液中钙离子的浓度为 (用含 V1、V2的代数式表示)g·mL-1。
a.[Kr]4d35s15p1b.[Kr]4d45s1c.Kr]4d2d.Kr]4d3
已知“石墨烯”的平面结构如图所示,一定条件下石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子杂化类型是,石墨烯导电的原因是。

|
物质 |
六氯苯
|
六溴苯
|
苯六酸
|
|
熔点/℃ |
231 |
325 |
287 |
|
水溶性 |
不溶 |
不溶 |
易溶 |
六溴苯的熔点比六氯苯高的原因是,苯六酸与六溴苯、六氯苯的水溶性存在明显的差异本质原因是。

羧酸 | pKa |
乙酸(CH3COOH) | 4.76 |
三氯乙酸(CCl3COOH) | 0.65 |
酸性比较:乙酸三氯乙酸(填“>”、“<”或“=”),并说明原因:;
 +(CH3CO)2O
+(CH3CO)2O
 +CH3COOH
+CH3COOH
主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:

粗产品
乙酰水杨酸
①实验过程中发现忘记加沸石,正确的处理方法是
②冷凝水的进水口是(填“a”或“b”)。
③提纯实验中乙酸乙酯的作用为。
④请设计实验判断粗产品中是否有未反应完全的水杨酸。