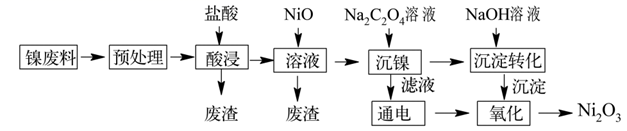
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 |
| 开始沉淀时pH | 1.8 | 3.0 | 7.1 | 5.8 |
| 完全沉淀时pH | 3.2 | 5.0 | 9.2 | 8.0 |
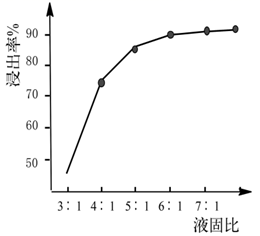
②常温下,盐酸的浓度为2.5mol·L-1 , “液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为,主要的原因是。