
| 选项 | 操作 | 现象 | 结论 |
| A | 将苯与液溴反应产生的气体通入AgNO3溶液中 | AgNO3溶液中出现淡黄色沉淀 | 证明苯与液溴发生了取代反应 |
| B | 向Al与Fe2O3反应后的固体产物中先加稀硫酸溶解,再加入几滴KSCN溶液 | 溶液不变红 | 无法证明反应后固体产物中是否含有Fe2O3 |
| C | 向H2O2溶液中加入几滴FeCl3溶液 | 溶液中产生气泡 | 发生的离子反应为:2Fe3++H2O2=O2↑+2Fe2++2H+ |
| D| | 向淀粉溶液中加入适量20%H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再滴加少量碘水 | 溶液未变蓝 | 淀粉已完全水解 |
[实验I]:KMnO4合成步骤过程如下图所示:

[实验II]:KMnO4纯度测定
称取自制的KMnO4晶体2.000g,配制成250.00mL溶液。取25.00mL0.1000mol/L草酸标准液溶液于锥形瓶中,加入25.00mL1mol/L硫酸,混合均匀后加热到75~85℃,用KMnO4溶液滴定,重复操作3次,平均消耗20.00mLKMnO4溶液。
请根据上述实验回答下列问题
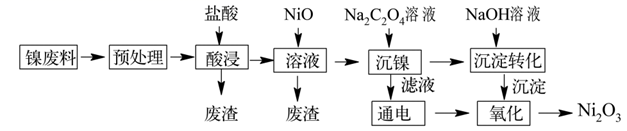
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 |
| 开始沉淀时pH | 1.8 | 3.0 | 7.1 | 5.8 |
| 完全沉淀时pH | 3.2 | 5.0 | 9.2 | 8.0 |
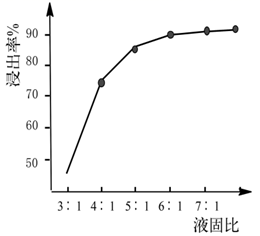
②常温下,盐酸的浓度为2.5mol·L-1 , “液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为,主要的原因是。
|
化学反应 |
正反应活化能 |
逆反应活化能 |
t℃时平衡常数 |
|
N2(g)+O2(g)=2NO(g) ∆H>0 |
akJ∙mol-1 |
bJ∙mol-1 |
K1 |
|
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ∆H<0 |
eJ∙mol-1 |
dJ∙mol-1 |
K2 |
请写出t℃时NH3被NO氧化生成无毒气体的热化学方程式(反应热用a、b、e、d代数式表示)。t℃该反应的平衡常数为(用K1和K2表示)。请解释该反应能否自发进行。
N2(g)+3H2(g)⇌2NH3(g) △H<0。测得不同条件、不同时间段内合成氨反应中N2的转化率,数据如下:
|
| 1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a | b |
①上表中T1T2(“>”“ <”或“=”表示),其中a、b、80%三者的大小关系是(用含“>”“<”或“=”的关系式表示)。
②研究表明,合成氨的速率与相关物质的浓度关系为v= ,k为速率常数。以下说法正确的是(填字母)
A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为17且保持不变,则反应达到平衡状态
C.将原容器中的NH3及时分离出来可使v增大
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大。
③已知某温度下该反应达平衡时各物质均为1mol,容器容积为1L,保持温度和压强不变,又充入3molN2后,平衡(填“向左移动”“向右移动”或“不移动”)。

A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
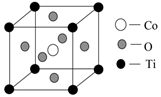
①晶胞中离Ti最近的O有个,其中Co原子位于O原子构成的空隙中。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
②已知该晶体的密度为ρg·cm-3 , 则晶胞中Ti与O的最近距离是nm(用含ρ、NA的代数式表示,相对原子质量O-16,Co-59,Ti-48)。
 是合成抗菌药磺胺甲唑的一种中间体,写出以乙二酸和丙酮(
是合成抗菌药磺胺甲唑的一种中间体,写出以乙二酸和丙酮(  )为原料合成该化合物的路线图(其他无机及有机试剂任选)。
)为原料合成该化合物的路线图(其他无机及有机试剂任选)。