
①下列说法错误的是。
A.锌块发生氧化反应:Zn-2e-=Zn2+
B.舰体有电子流入,可以有效减缓腐蚀
C.若通过外加电源保护舰体,应将舰体与电源正极相连
D.地下钢铁管道用导线连接锌块与该种舰体保护法原理相同
②采用“牺牲阳极的阴极保护法”后,舰体上正极的电极反应式为。
①据了解铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。
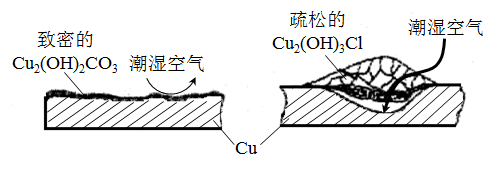
下列说法正确的是
A.疏松的Cu2(OH)3Cl属于有害锈
B.Cu2(OH)2CO3既能溶于盐酸也能溶于氢氧化钠溶液
C.青铜器表面涂一层食盐水可以做保护层
D.用HNO3溶液除锈可以保护青铜器的艺术价值,做到“修旧如旧”
②文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,可以使CuCl转化为难溶的Cu2(OH)2CO3反应的离子方程式为。