| 选项 | 古文或古诗词 | 说明 |
| A | 冰,水为之,而寒于水 | 冰变成水过程中放出能量 |
| B | 蜡烛成灰泪始干 | 蜡烛燃烧过程中化学能全部转化为光能 |
| C | 日照香炉生紫烟 | 紫烟指的是碘的升华 |
| D | 用浓酒和糟入甑,蒸令气上,用器承滴露 | 该过程中利用到蒸馏原理 |

第一步:Cl2⇌2Cl 快速平衡
第二步:Cl+CO⇌COCl 快速平衡
第三步:COCl+Cl2→COCl2+Cl 慢反应
下列说法正确的是( )



| 起始物质的量mol | 甲 | 乙 | 丙 |
| n(N2) | 1 | 2 | 2 |
| n(H2) | 3 | 3 | 6 |
A.加入少量Na2CO3固体 B.不加任何物质 C.加入少量Na2SO3固体

①下列说法错误的是。
A.锌块发生氧化反应:Zn-2e-=Zn2+
B.舰体有电子流入,可以有效减缓腐蚀
C.若通过外加电源保护舰体,应将舰体与电源正极相连
D.地下钢铁管道用导线连接锌块与该种舰体保护法原理相同
②采用“牺牲阳极的阴极保护法”后,舰体上正极的电极反应式为。
①据了解铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。
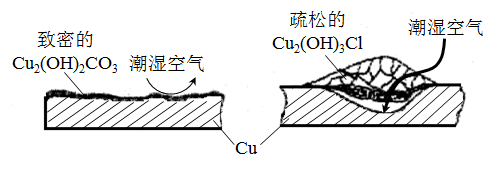
下列说法正确的是
A.疏松的Cu2(OH)3Cl属于有害锈
B.Cu2(OH)2CO3既能溶于盐酸也能溶于氢氧化钠溶液
C.青铜器表面涂一层食盐水可以做保护层
D.用HNO3溶液除锈可以保护青铜器的艺术价值,做到“修旧如旧”
②文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,可以使CuCl转化为难溶的Cu2(OH)2CO3反应的离子方程式为。

已知:①PbC2O4完全分解的化学方程式为PbC2O4 PbO+CO↑+CO2↑。②PbCrO4难溶于水。回答下列问题:

电极B为极,反应过程中每转移0.3mol电子,可消除有害气体的体积为L(标准状况下)。