选项 | 人类活动 | 化学原理 |
A | NH4Cl溶液除铁锈 | NH |
B | 游轮底部定期更换锌块 | 利用电解原理可防止腐蚀 |
C | 铝罐贮运浓硝酸 | 铝具有良好导热性 |
D | NH4HCO3可用作氮肥 | NH4HCO3受热易分解 |
| | | | |
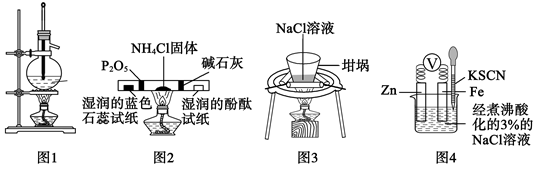
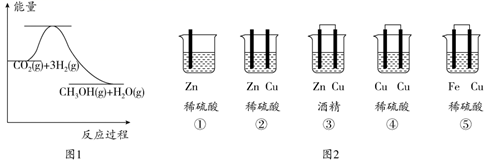
| A.关闭a,打开b,可检验装置的气密性 | B.比较KMnO4、Cl2、S的氧化性强弱 | C.验证铁钉能发生析氢腐蚀 | D.检验乙醇消去反应的产物乙烯 |
| ① | ② | ③ |
| | | |
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法错误的是( )
用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.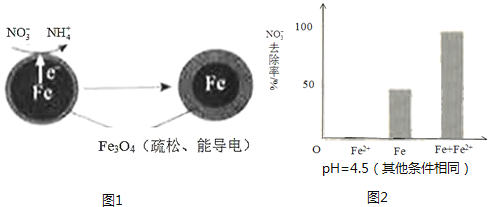
①作负极的物质是.
②正极的电极反应式是.
将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因:.
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因:.
![]()
①B的化学式;D的颜色。
②实验室中常用A和另一种固体制备B,写出相应的化学方程式。
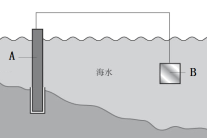
①图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择(填字母标号)。
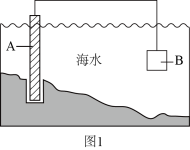
a.碳棒 b.锌板 c.铜板
②镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的(填“正”或“负”)极。F电极上的电极反应式为。
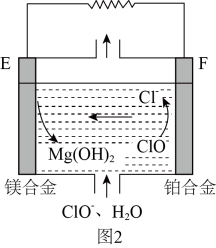
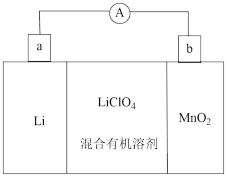
①a电极为该电池的极;
②该电池正极的电极反应式为。
电有机合成反应条件温和,生产效率高。电解合成1,二氯乙烷
的实验装置如图所示。回答下列问题:
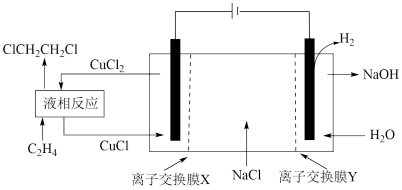
①离子交换膜X为交换膜(填“阳离子”或“阴离子”);
②阴极区的电极反应式是;
③阳极区发生的液相反应化学方程式为。
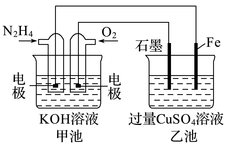
①甲池中N2H4发生的是(填“氧化反应”或“还原反应”),乙池中SO向移动(填“左”或“右”)。
②乙池中总反应的离子方程式为。
③要使乙池恢复到反应前的状态,应向溶液中加入(填化学式)。
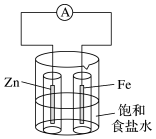
锌棒上发生的电极反应为;铁棒上发生的电极反应为。
实验Ⅱ中电流表指针的偏转方向与实验Ⅰ(填“相同”或“相反”)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:。
工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。

此过程中能量转化形式为转化为(填“化学能”或“电能”)
a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为 NaClO、ClO2 等含氯化合物可用于杀菌消毒
某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。

被腐蚀的是包裹的铁钉(填“锌片”或“铜片”)
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
|
装置 |
编号 |
电极A |
溶液B |
操作及现象 |
|
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
① 同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是。
② 针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是。
|
编号 |
溶液B |
操作及现象 |
|
Ⅲ |
经煮沸的pH=2的 H2SO4 |
溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
|
Ⅳ |
pH=2的H2SO4 |
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
|
Ⅴ |
pH=12的NaOH |
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
① 丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是。

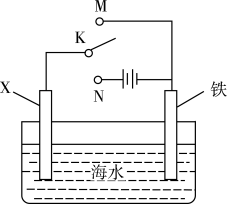
①下列说法错误的是。
A.锌块发生氧化反应:Zn-2e-=Zn2+
B.舰体有电子流入,可以有效减缓腐蚀
C.若通过外加电源保护舰体,应将舰体与电源正极相连
D.地下钢铁管道用导线连接锌块与该种舰体保护法原理相同
②采用“牺牲阳极的阴极保护法”后,舰体上正极的电极反应式为。
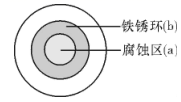
①据了解铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。
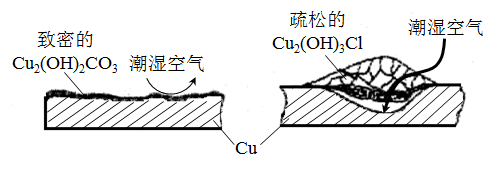
下列说法正确的是
A.疏松的Cu2(OH)3Cl属于有害锈
B.Cu2(OH)2CO3既能溶于盐酸也能溶于氢氧化钠溶液
C.青铜器表面涂一层食盐水可以做保护层
D.用HNO3溶液除锈可以保护青铜器的艺术价值,做到“修旧如旧”
②文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,可以使CuCl转化为难溶的Cu2(OH)2CO3反应的离子方程式为。