1.
(2022·昌吉模拟)
As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水[砷主要以亚砷酸(H3AsO3)形式存在]通过如下流程转化为粗As2O3。
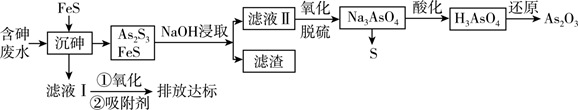
已知:Ⅰ. As2S3+ 6NaOH = Na3AsO3 + Na3AsS3+ 3H2O
Ⅱ. As2S3(s) + 3S2-(aq)  2
2  (aq)
(aq)
Ⅲ.砷酸(H3AsO4)在酸性条件下有强氧化性,能被SO2、氢碘酸等还原。
-
-
-
(2)
“沉砷”过程中FeS是否可以用过量的Na2S替换(填“是”或“否”);请从平衡移动的角度解释原因:。
-
-
(3)
向滤液Ⅱ中通入氧气进行“氧化脱硫”,写出脱硫的离子反应方程式。
-
-
(4)
用SO2“还原”过程中,发生反应的化学方程式为。若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有。
-
-
(5)
“还原”后加热溶液,H
3AsO
3分解为As
2O
3 , 同时结晶得到粗As
2O
3 , As
2O
3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As
2O
3的沉淀率,“结晶”需要控制的具体条件是
。

-
-
(6)
含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为Ca
3(AsO
4)
2沉淀。若沉降后上层清液中
c(Ca
2+)为2×10
-3mol/L,则溶液中

的浓度为
mol/L。(已知
Ksp[Ca
3(AsO
4)
2]=8×10
-19)
-

2
(aq)
