[已知
,
,
的电离常数
],下列有关说法正确的是






下列说法错误的是( )

| 选项 | 实验操作和现象 | 结论 |
| A | 将燃着的镁条迅速伸入集满CO2的集气瓶,剧烈反应,发光发热,瓶内产生大量白烟,瓶壁上有黑色颗粒 | CO2在一定条件下能支持燃烧 |
| B | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 将少量铁粉、5mL苯和1mL液溴混合后产生的气体通入AgNO3溶液中,产生淡黄色沉淀 | 苯和液溴发生了取代反应 |
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
|
实验编号 |
反应物组成 |
|
a |
|
|
b |
|
|
c |
|
|
d |
|
|
e |
|
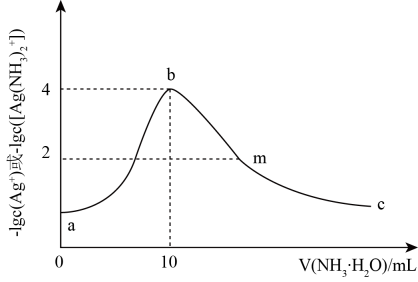
回答下列问题:
①
②
③
则的
。

回答下列问题:


①若FeS2原电池中生成单质S,其电池总反应的离子方程式为。
②随硫铁矿的增加,锰的浸出率降低,可能的原因是。
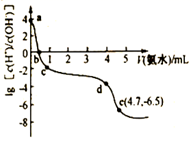
①写出由Mn(OH)2反应得到Mn3O4的化学方程式。
②沉淀加热通空气过程中溶液pH随时间变化如图所示,其中pH先基本不变后迅速下降的原因是。

③所得产物中锰元素含量随通入空气时间的变化如图所示,当通空气时间超8小时,产物中锰元素含量减小的原因是。

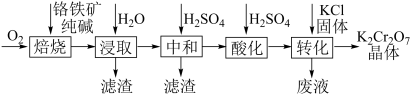

①钡盐沉淀法。先将K2Cr2O7酸性废液碱化处理,再加入BaCl2.废液需进行碱化处理的目的是。[已知:BaCrO4(s)Ba2+(aq)+ CrO
(aq) ΔH>0;Ksp(BaCrO4)=1.2×10-10]
②FeS还原法。在K2Cr2O7酸性废液中加入纳米FeS后,测得Cr(Ⅵ)和总铬去除率随时间的变化关系如图所示,反应过程中还检测到Cr2S3沉淀。10 min后,Cr(Ⅵ)和总铬的去除率升高幅度变小的可能原因是。


已知:①高铁酸钾热稳定性差
②在碱性环境中比酸性环境中相对稳定。
回答以下问题:

①+
+2H2O=
+Fe(OH)3↓+OH-
②2+2H+=
+H2O
③+6Fe2++14H+=2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2 , 充分反应后过滤,将滤液加水配制成250 mL溶液。每次取25.00 mL,加入稀硫酸酸化,用0.1000 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为。

已知:是白色粉末,不溶于水,能与过量
继续反应:
, 从而溶于
溶液中。
回答下列问题:

已知:1:①"酸浸”时,和
先与稀硫酸反应分别生成
和
;
②有机萃取剂萃取的能力比萃取
的能力强;
③微溶于冷水、易溶于热水、难溶于乙醇;
④溶液中与
可相互转化:
。
回答下列问题:
①“反萃取”操作加入的试剂是(填化学式)。
②假设“滤液2”中 , “萃取”和“反萃取”每进行一次,
萃取率为90%,5次操作后,“滤液2”中残留的
【萃取率=
】。
②实验发现,温度超过以后沉钒率下降,可能的原因是。
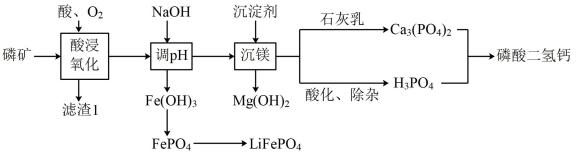
已知: Ksp[Fe(OH)3]=1×10-38 , Ksp[Mg(OH)2]= 1 ×10-11。
回答下列问题:

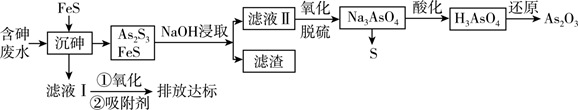
已知:Ⅰ. As2S3+ 6NaOH = Na3AsO3 + Na3AsS3+ 3H2O
Ⅱ. As2S3(s) + 3S2-(aq) 2
(aq)
Ⅲ.砷酸(H3AsO4)在酸性条件下有强氧化性,能被SO2、氢碘酸等还原。

![]()
已知:①Li2CO3在不同温度下的溶解度: 0℃ 1.54g,20℃ 1.33g, 90℃ 0.78g。
②碳酸锂:水溶液煮沸时容易发生水解。

①滴液漏斗中的液体是 。
②Li3PO4转化为LiCl和CaHPO4的离子方程式为 。
①方法能制得Li2CO3的原因是。
②检验滤渣是否洗涤完全的实验方法是。


