I.2NO(g)+O2(g)⇌2NO2(g) K1=3. 3×1013
II.2NO(g)⇌N2(g)+O2(g) K2=2. 2× 1030
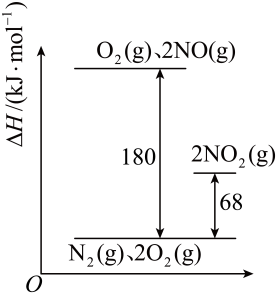
则该温度下,反应III:2NO2(g)⇌N2(g)+2O2(g) K3= (计算结果保留一位小数),反应II与反应III相比分解趋势较大的反应是(填“反应II”或“反应III ”)。
序号 | c(NO)/(mol·L-1) | c(H2)/ (mol·L-1) | v正/(mol·L-1·min-1) |
I | 0.10 | 0.10 | 0.414k正 |
II | 0.10 | 0.20 | 0.828k正 |
III | 0.30 | 0.10 | 3.726k正 |
①v正 =k正cm(NO)·cn(H2)中,m=、n=。
②经研究,有人提出上述反应分两步进行: I. 2NO(g)+ H2 (g)=N2 (g) + H2O2(g);II. H2(g)+H2O2(g)=2H2O(g)。化学总反应由较慢的一步反应决定。上述反应中II反应较快,则反应I正反应活化能 (填“大于”“小于”或“等于”)反应II正反应活化能。
