1.
(2023·赣州模拟)
将CO2转化为高附加值碳基燃料,可有效减少碳的排放。在催化剂作用下CO2甲烷化的总反应为:
 CO2(g)+2H2(g)
CO2(g)+2H2(g)
 CH4(g)+H2O(g),ΔH总Kp总 , 该反应分两步完成,反应过程如下:
CH4(g)+H2O(g),ΔH总Kp总 , 该反应分两步完成,反应过程如下:
①CO2(g)+H2(g) CO(g)+H2O(g),ΔH1Kp1
CO(g)+H2O(g),ΔH1Kp1
②CO(g)+H2(g)
 CO2(g)+
CO2(g)+ CH4(g),ΔH2Kp2
CH4(g),ΔH2Kp2
回答下列问题:
-
(1)
催化剂的选择是CO
2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO
2转化率和生成CH
4选择性随温度的变化如图所示。
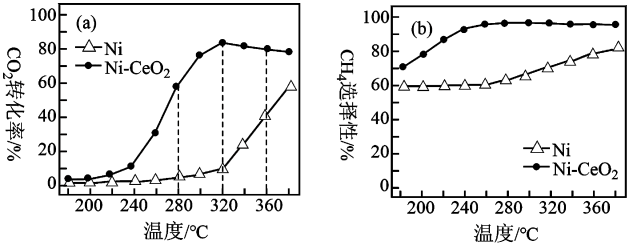
对比上述两种催化剂的催化性能,工业上应选择的催化剂是,使用的合适温度为。
-
-
(2)
在某温度下,向恒容容器中充入7molCO2和12molH2 , 初始压强为19kPa,反应经10min达到平衡,此时p(H2O)=5kPa,p(CO)=4kPa,则总反应的v(H2)=kPa·min-1。试计算该温度下反应①的Kp1(用平衡分压代替平衡浓度);在该平衡体系,若保持温度不变压缩容器的体积,CH4的物质的量(填“增加”“减小”或“不变”),反应①的平衡将(填“正向”“逆向”或“不”)移动。
-
-
(3)
为研究反应过程的热效应,一定温度范围内对上述反应的平衡常数K
p进行计算,得lgKp-T的线性关系如图:
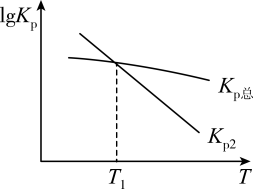
则T1温度下Kp1=,从图像分析反应①的ΔH10(填“>”“<”或“=”)。
-
CO2(g)+2H2(g)
CH4(g)+H2O(g),ΔH总Kp总 , 该反应分两步完成,反应过程如下:
CO(g)+H2O(g),ΔH1Kp1
CO2(g)+
CH4(g),ΔH2Kp2

