
选项 | 实验操作 | 现象 | 结论或解释 |
A | 取5mL0.1mol/LFeCl3溶液,滴加5~6滴0.1mol/LKI溶液,充分反应后,再滴加KSCN溶液 | 溶液变红 | FeCl3和KI的反应是可逆反应 |
B | 将足量SO2通入Na2CO3溶液中逸出的气体通入足量的酸性KMnO4溶液,再通入澄清石灰水中 | 酸性KMnO4溶液颜色变浅,澄清石灰水变浑浊 | Ka1(H2SO3)>Ka1(H2CO3) |
C | 将脱脂棉放入试管中,加入浓硫酸后搅成糊状,微热得到亮棕色溶液,加入新制Cu(OH)2悬浊液,加热 | 有砖红色沉淀生成 | 说明水解产物含有葡萄糖 |
D | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2>Fe3+ |




已知:常温时Ksp(CaF2)=2.7×10-11 , Ksp(CuS)=1.0×10-36;Fe3+不能氧化Ni2+。有关氢氧化物开始沉淀的pH和完全沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
完全沉淀的pH | 3.7 | 9.7 | 9.2 |

有关信息如下表:
化学式 | Sn | SnCl2 | SnCl4 |
熔点/℃ | 232 | 246 | -33 |
沸点/℃ | 2260 | 652 | 114 |
其他性质 | 银白色固体金属 | 无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+ | 无色液体,易水解生成SnO2 |
①实际制备的产品往往含有SnCl2 , 甲同学设计实验测定Sn2+的含量:准确称取mg产品于锥形瓶中,用蒸馏水溶解,用amol/L酸性高锰酸钾标准溶液滴定,滴定终点时消耗酸性高锰酸钾标准溶液V1mL。由此可计算产品中Sn2+的质量分数。乙同学认为甲同学的方案明显不合理,会导致测得的Sn2+的质量分数严重偏高,理由是。
②乙同学设计实验测定产品中Cl-的含量:准确称取mg产品于锥形瓶中,用蒸馏水溶解,X溶液作指示剂,用bmol/L硝酸银标准溶液滴定,滴定终点时消耗硝酸银溶液V2mL。硝酸银溶液最好盛放在(填序号)滴定管中。
A.无色酸式滴定管B.棕色酸式滴定管C.无色碱式滴定管D.棕色碱式滴定管
参考表中的数据,X溶液最好选用的是(填序号)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 白 | 砖红 |
Ksp | 1.77×10-10 | 5.4×10-14 | 2.7×10-16 | 1.12×10-12 |
A.NaCl溶液B.NaBr溶液C.NaCN溶液D.Na2CrO4溶液
CO2(g)+2H2(g)
CH4(g)+H2O(g),ΔH总Kp总 , 该反应分两步完成,反应过程如下:
①CO2(g)+H2(g)CO(g)+H2O(g),ΔH1Kp1
②CO(g)+H2(g)CO2(g)+
CH4(g),ΔH2Kp2
回答下列问题:
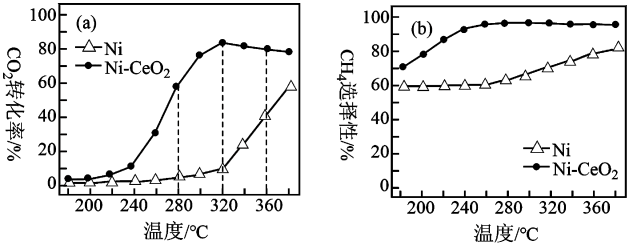
对比上述两种催化剂的催化性能,工业上应选择的催化剂是,使用的合适温度为。
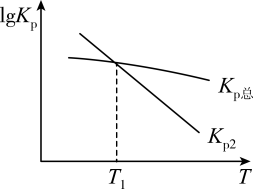
则T1温度下Kp1=,从图像分析反应①的ΔH10(填“>”“<”或“=”)。



①除苯环外不含其他环状结构
②含有硝基,且直接连在苯环上
其中核磁共振氢谱有四组峰,且峰面积之比为2:2:2:1的结构简式为。