[步骤一]从天青石到粗SrCO3:
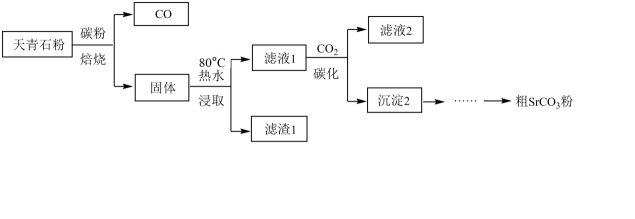
已知:i. Ca、Sr、Ba硫化物( MS)和硫氢化物[ M( HS)2]均易溶于水,
ii.20℃时,Sr(OH)2、Ba(OH)2、Ca(OH)2的溶解度(单位为g)分别为1.77、3. 89、0.173;80℃时,Sr(OH)2、 Ba(OH)2、Ca(OH)2的溶解度(单位为g)分别为20. 2、101.4、0.094。
粗SrCO3中的杂质是BaCO3.有同学提出在实验室可以将粗SrCO3产物溶于酸,再加入Na2SO4溶液实现Sr和Ba的分离。设Ba2+完全沉淀时c(Ba2+)= 10-5mol·L-1 , 则溶液中c(Sr2+)一定不大于。该方案(填“合理”或者“不合理”)。[Ksp( BaSO4)= 1.1×10-10 , Ksp(SrSO4)= 3.3×10-7]
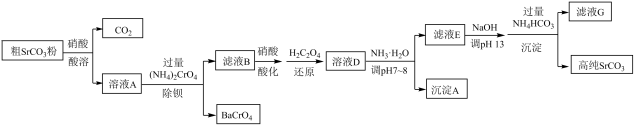
已知:i.溶液中存在 +H2O
2
+2H+ ,
具有强氧化性。
ii. Cr( OH)3的性质类似Al( OH)3 , Ksp[ Cr(OH)3]=1×10-31。
①若酸溶过程中H+过量太多,则除钡过程中Ba2+去除率会下降,请从化学平衡移动角度解释原因。
②还原过程中草酸(H2C2O4)发生反应的离子方程式为。
③为除铬,向溶液D中加入NH3·H2O调节pH为7~8。此过程不调节pH为13的原因是。