容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
Ⅰ | T1 | 0.2 | 0.2 | 0.1 |
Ⅱ | T2 | 0.2 | 0.2 | 0.12 |
下列说法错误的是( )





下列说法正确的是( )
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |

以下结论和解释正确的是( )
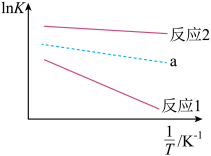
反应1:![]() (g)
(g) ![]() (g) + H2(g)
(g) + H2(g)
反应2:![]() (g)
(g) ![]() (g) +H2(g)
(g) +H2(g)
反应3:![]() (g)
(g) ![]() (g)
(g)
已知: , 其中R、C均为常数。反应1和反应2的
随
变化关系曲线如图所示,下列说法正确的是( )
目的 | 操作 | |
A | 验证淀粉未水解 | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,观察颜色变化。 |
B | 验证 | 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液的pH约为10;0.1mol/LNaHSO3溶液的pH约为5. |
C | 探究维生素C的还原性 | 向盛有2mL黄色FeCl3溶液的试管中滴加浓的维生素C溶液,观察颜色变化。 |
D | 研究温度对化学平衡的影响 | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温,观察颜色变化。 |

容器 | n(CO2)/mol | n(C)/mol | n(CO)/mol |
甲 | 0.2 | 0.6 | 0 |
乙 | 0.4 | 0.8 | 0 |
丙 | X<0.6 | 1 | 0 |
实验 | 试剂 | 现象 | |
试管 | 滴管 | ||
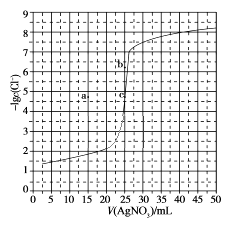
| 2mL[Ag(NH3)2]Cl溶液 | 6滴0.1 mol∙L−1KCl溶液 | I中无明显现象 |
6滴0.1 mol∙L−1KI溶液 | II中产生黄色沉淀 | ||
6滴0.1 mol∙L−1HCl溶液 | III中产生白色沉淀 | ||
6滴饱和KCl溶液 | IV中产生白色沉淀 | ||
下列说法错误的是
Ⅰ.4NH3(g)+5O2(g)4NO(g)+6H2O(g)
Ⅱ.4NH3(g)+3O2(g)2N2(g)+6H2O(g)
现将1molNH3、1.45molO2充入1L恒容密闭容器中,在上述催化剂作用下反应,相同时间内有关生成物物质的量随温度变化曲线如图所示:

已知:有效转化率=×100%
下列说法错误的是

下列说法正确的是( )
反应1
kJ·mol
反应2
kJ·mol
将体积比为1∶1的、
混合气体按一定流速通过催化反应管,测得
、
的转化率随温度变化的关系如图所示。

已知的选择性
下列说法正确的是
实验操作 | 现象 | 原理解释 | |
A | 向ZnS沉淀上滴加适量0.1mol/LCuSO4溶液,振荡试管 | 沉淀变为黑色 | Kap(ZnS)>Kap(CuS) |
B | 将乙醇与浓硫酸混合加热产生的气体通入酸性KMnO4溶液中 | 溶液紫红色褪去 | 乙醇分子内脱水生成乙烯,乙烯具有还原性 |
C | 向植物油中加入Na2CO3溶液,加热 | 溶液不再分层 | 碳酸钠溶液呈碱性: |
D | 实验室中加热KClO3和MnO2固体混合物制氧气 | 反应前后MnO2的质量没有发生变化 | MnO2没有参与反应 |

已知:
Ⅰ.N2(g)+3H2(g)⇌2NH3(g) ΔH1= -92 kJ·mol-1
Ⅱ. C(s)+O2(g)⇌CO2(g) ΔH2= - 394 kJ·mol-1
Ⅲ. N2(g)+ 3H2(g)+C(s)+O2(g)⇌H2NCOONH4(s) ΔH3= - 646 kJ·mol-1
Ⅳ.H2NCOONH4(s)⇌2NH3(g)+ CO2(g) ΔH4
回答下列问题:
A.当N2的体积分数不变时,说明反应已经达到化学平衡状态
B.温度升高化学反应速率加快,化学平衡常数增大
C.其他条件不变时,若适当增加N2的用量,可以提高H2的平衡转化率
D.使用合适的催化剂可以加快化学反应速率,但ΔH1不变

某学习小组的同学通过讨论得出结论: 200℃时, a点对应的转化率(5%)不是使用催化剂甲下H2的平衡转化率。判断依据是:。

该反应的化学平衡常数表达式是。根据图1,用N2表示该反应达平衡过程中的平均反应速率是mol/(L·min)。
a.其他条件不变,若充入N2 , 达到新平衡时,、
均增大
b.加入催化剂可提高NO的平衡转化率
c.若适当增大压强,则平衡正向移动
d.其他条件不变,若容器体积扩大一倍,达到新平衡时,c(N2)小于原来的一半
实验编号 | T(K) | NO的初始浓( | CO的初始浓度 ( | 催化剂的比表面积 ( |
I | T0 | 75 | ||
II | T0 | 50 |
在图3中画出表中实验II条件下混合气体中NO的浓度随时间变化的曲线。



已知:
a.萃取剂E是溶解了P204(记为HA)的磺化煤油(一种有机溶剂);
b.HA为一元弱酸,难溶于水,结构为 [OR=
[OR= ];
];
c.莘取时发生反应M2++2HAMA2+2H+(M2+表示Ca2+或Mn2+)。
①从结构角度分析MA2可溶于磺化煤油的原因:。
②反应M2++2A-MA2的平衡常数用β表示。已知β(CaA2)>β(MnA2),判断调pH时ab(填“<”或“>”),结合平衡常数解释原因:。
③试剂Y是。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
溶解度/g | 52.9 | 59.7 | 62.9 | 62.9 | 60.0 | 53.6 | 45.6 | 40.9 | 35.3 |
过程II的操作为,洗涤,干燥。
反应I:甲醇醚化反应(DME)
反应II:含氧化合物制丙烯反应(OTP)
已知部分键能数据如下:
化学键 | C-C | C=C | C-H | H-H | O-H | C=O | C-O |
键能/ | 356 | 615 | 413 | 436 | 462 | 745 | 360 |
回答下列问题:
|
| 丙烯选择性/% | 乙烯选择性/% |
0.10 | 0 | 30.9 | 7.51 |
0.08 | 0.02 | 32.0 | 7.42 |
0.04 | 0.06 | 34.8 | 7.03 |
0.02 | 0.08 | 36.7 | 6.48 |
0.01 | 0.09 | 39.4 | 5.43 |
分析表中数据:要合成得到更多的丙烯,应控制甲醇的最佳分压为MPa。


①氢原子与其它原子之间存在的作用力类型有。
②已知:当Cu(II)配合物A和B配位构型由八面体转变为四方平面时,吸收光谱蓝移,配合物颜色由紫色变为橙色(如图所示)。

若将配合物的颜色由紫色调整为橙色,需要进行的简单操作为。


①。
②在某温度下,在体积为1L的恒容容器中,投料为1molCO和2molH2 , 仅发生反应II和III , 在
时达到平衡状态,请画出
之间
的变化趋势。

|
序号 |
加热温度/℃ |
反应物气体流速/ |
|
|
|
|
1 |
800 |
4 |
1:1 |
79.6 |
52.2 |
|
2 |
800 |
6 |
1:1 |
64.2 |
61.9 |
|
3 |
800 |
6 |
1:2 |
81.1 |
41.6 |
①下列说法错误的是。
A.反应I可以储能的原因是该反应是吸热反应,将热量储存在高热值物质CO、H2中
B.其他条件不变,反应物气体流速越小,CH4转化率越大,有利于热化学能储存
C.其他条件不变,越小,CH4转化率越大
D.反应物气体流速越大,CH4转化率越低的可能原因是反应物与催化剂未充分接触
②在实验2和3中,经过相同的时间,混合气中CO2占比越低,储能效率越高,说明其可能的原因。(该条件下设备的加热功率视为不变)
①4NH3(g) + 5O2(g) 4NO (g) + 6H2O(g) ΔH1= - 905kJ·mol-1
②4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g) ΔH2=- 1268kJ· mol-1
③4NH3(g) + 6NO(g) 5N2(g) + 6H2O(g) ΔH3
反应③的反应热ΔH3=。

①根据以上信息,其他条件不变时,下列措施中可以提高NH3转化为N2的平衡转化率的是(填字母)。
A.升高反应温度 B.降低反应温度
C.增大NH3和O2的初始投料比 D.及时分离出H2O
②520℃-840℃时体系中NO含量迅速增加的原因是。

I.2NO(g) N2O2(g)
II.N2O2(g)+O2(g) 2NO(g)
①决定NO氧化反应速率的步骤是(填“I”或“II”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,在温度为T1和T2(T2>T1),测得c(NO)随t(时间)的变化曲线如图b,转化相同量的NO,在温度 (填“T1”或“T2”)下消耗的时间较长,结合图a分析其原因。


①该反应的催化剂是,该物质还有另一个作用一提高DMC的平衡产率,结合反应机理图分析其中的原因:。
②将物质的量之比为1∶2的和
的混合气体以相同流速通过两种不同的催化剂a、b,仅发生反应Ⅱ.相同时间内
的转化率如图2所示。

M点(填“是”或“不是”)对应温度下的的平衡转化率,原因是。
①对于反应Ⅱ,活化能(填“>”或“<”)
。
②时,该温度下
。某温度下,在5L恒容密闭容器中充入5mol
和10mol
, 发生反应Ⅰ、Ⅱ,反应经10min达到平衡,此时
,
, 则
已知:i.2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH1
ii.CH3OCH3(g)+CO(g)CH3COOCH3(g) ΔH2
iii.CH3COOCH3(g)+2H2(g)CH3CH2OH(g)+CH3OH(g) ΔH3
在恒温恒容密闭容器中充入3molCO(g)和7molH2(g)仅发生反应3CO(g)+6H2(g)CH3CH2OH(g)+CH3OH(g)+H2O(g),下列叙述正确的是(填标号)。
A.混合气体总压强不随时间变化时,反应达到平衡状态
B.反应达到平衡时,CH3CH2OH体积分数可能为25%
C.反应达到平衡后,再充入少量CO,CO的平衡转化率增大
D.反应达到平衡后,再加入高效催化剂,乙醇产率保持不变
①醋酸酯加氢的催化效能如表所示:
实验组 | 催化剂 | 原料 | 反应条件 | 反应性能 | ||
温度/℃ | 压力/MPa | 转化率/% | 选择性/% | |||
1 | Cu/SiO2 | 醋酸甲酯 | 190 | 28 | 96.1 | 99.0 |
2 | Cu-Cr | 醋酸乙酯 | 250 | 2.8 | 接近完全 | 93.8 |
3 | Cu/ZnO | 醋酸乙酯 | 185 | 1 | 56 | 99.0 |
4 | Cu/SiO2 | 醋酸乙酯 | 280 | 4.0 | 94.6 | 96.6 |
上述实验中,催化效能最好的为实验(填序号),与之对比,实验3中,醋酸酯平衡转化率较低的主要原因可能是(从表中所给条件的角度分析)。
②醋酸甲酯加氢历程一般认为可分为如下步骤(*代表催化剂位点,已知:CH3CO*+H·→CH3CHO):
a.CH3COOCH3→CH3CO·+CH3O·
b.CH3CO·+*→CH3CO*(慢)
c.CH3O·+*→CH3O*(快)
d.CH3CO*+3H·→CH3CH2OH
e.CH3O*+H·→CH3OH
……
其中,在b和c的步骤中,活化能较小的是(填标号,下同),控制总反应速率的步骤是,分析上述步骤,副产物除CH3OH外,还可能有(写一种即可)。
以CO2、H2为原料合成CH3OH涉及的反应如下:
iv.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH4<0
v.CO2(g)+H2(g)CO(g)+H2O(g) ΔH5>0
vi.CO(g)+2H2(g)CH3OH(g) ΔH6<0
在不同压强下、按照n(CO2)∶n(H2)=1∶3进行投料,在器容中发生上述3个反应,平衡时,CO和CH3OH在含碳产物(即CH3OH和CO)中物质的量分数及CO2的转化率随温度的变化如图,压强p1、p2、p3由大到小的顺序为,曲线(填“m”或“n”)代表CH3OH在含碳产物中物质的量分数,在T1℃下,压强为p3时,反应v的浓度平衡常数Kc=(填含α的表达式)。

[步骤一]从天青石到粗SrCO3:
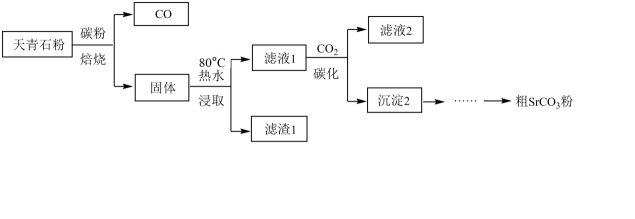
已知:i. Ca、Sr、Ba硫化物( MS)和硫氢化物[ M( HS)2]均易溶于水,
ii.20℃时,Sr(OH)2、Ba(OH)2、Ca(OH)2的溶解度(单位为g)分别为1.77、3. 89、0.173;80℃时,Sr(OH)2、 Ba(OH)2、Ca(OH)2的溶解度(单位为g)分别为20. 2、101.4、0.094。
粗SrCO3中的杂质是BaCO3.有同学提出在实验室可以将粗SrCO3产物溶于酸,再加入Na2SO4溶液实现Sr和Ba的分离。设Ba2+完全沉淀时c(Ba2+)= 10-5mol·L-1 , 则溶液中c(Sr2+)一定不大于。该方案(填“合理”或者“不合理”)。[Ksp( BaSO4)= 1.1×10-10 , Ksp(SrSO4)= 3.3×10-7]
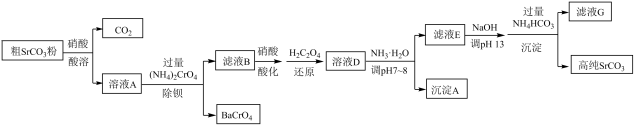
已知:i.溶液中存在 +H2O
2
+2H+ ,
具有强氧化性。
ii. Cr( OH)3的性质类似Al( OH)3 , Ksp[ Cr(OH)3]=1×10-31。
①若酸溶过程中H+过量太多,则除钡过程中Ba2+去除率会下降,请从化学平衡移动角度解释原因。
②还原过程中草酸(H2C2O4)发生反应的离子方程式为。
③为除铬,向溶液D中加入NH3·H2O调节pH为7~8。此过程不调节pH为13的原因是。