 互为同分异构体。
互为同分异构体。
|
|
|
|
A.用做SO2喷泉实验 | B.探究压强对平衡的影响 | C.探究生铁在不同条件下的电化学腐蚀 | D.验证Cu与浓硝酸反应的热量变化 |


[步骤一]从天青石到粗SrCO3:
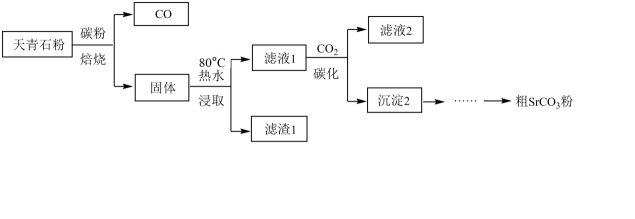
已知:i. Ca、Sr、Ba硫化物( MS)和硫氢化物[ M( HS)2]均易溶于水,
ii.20℃时,Sr(OH)2、Ba(OH)2、Ca(OH)2的溶解度(单位为g)分别为1.77、3. 89、0.173;80℃时,Sr(OH)2、 Ba(OH)2、Ca(OH)2的溶解度(单位为g)分别为20. 2、101.4、0.094。
粗SrCO3中的杂质是BaCO3.有同学提出在实验室可以将粗SrCO3产物溶于酸,再加入Na2SO4溶液实现Sr和Ba的分离。设Ba2+完全沉淀时c(Ba2+)= 10-5mol·L-1 , 则溶液中c(Sr2+)一定不大于。该方案(填“合理”或者“不合理”)。[Ksp( BaSO4)= 1.1×10-10 , Ksp(SrSO4)= 3.3×10-7]
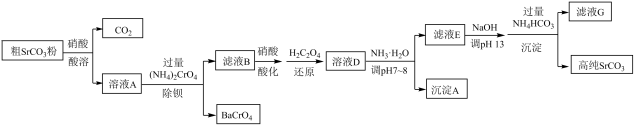
已知:i.溶液中存在 +H2O
2
+2H+ ,
具有强氧化性。
ii. Cr( OH)3的性质类似Al( OH)3 , Ksp[ Cr(OH)3]=1×10-31。
①若酸溶过程中H+过量太多,则除钡过程中Ba2+去除率会下降,请从化学平衡移动角度解释原因。
②还原过程中草酸(H2C2O4)发生反应的离子方程式为。
③为除铬,向溶液D中加入NH3·H2O调节pH为7~8。此过程不调节pH为13的原因是。
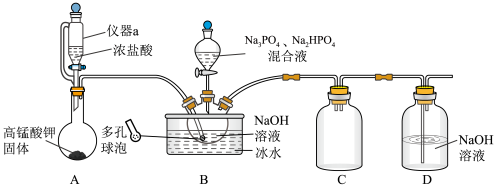
问答下列问题:
①上述装置存在一处缺陷,会使”消洗灵”(Na10P3O13Cl·5H2O)的产率降低,改进的方法是。
②“系列操作”包括、、过滤、洗涤、低温干燥。
I.取4.00g产品试样溶于蒸馏水中配成200mL溶液;
II.量取20. 00 mL待测液于锥形瓶中,加入10 mL2 mol·L-1硫酸溶液、25 mL0.1 mol·L-1KI溶液(过量) ,暗处静置5min;
III.滴加2~3滴淀粉溶液,用0. 0500 mol ·L-1Na2S2O3标准溶液滴定,发生反应: I2+2 =2I-+
。平行滴定三次,平均消耗20. 00 mL标准溶液。
①Na2S2O3标准液应放在 ( 填“碱”或“酸”)式滴定管中。
②则产品的纯度为(保留三位有效数字)。

①能说明容器中的反应均已达到平衡状态的是。
A.容器内气体的平均相对分子质量不变
B. CO2和H2的转化率相等
C. H2(g)与C(s)的物质的量之比保持不变
D.v(H2)=v( H2O)
②ΔH0( 填“>”“<”或“不确定”) ;理由是。
③改变的条件是。
反应I :CO2(g) +3H2(g) CH3OH(g)+H2O(g) ΔH =-49.6 kJ ·mol-1
反应II :2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH =-23.4 kJ·mol-1
反应III :2CO2(g) +6H2(g) CH3OCH3 (g) +3H2O(g)
①反应III的活化能Ea(正)Ea(逆)(填“>”“<”或“=”)。
②在T1温度下,将6molCO2和14molH2充入2L的恒容密闭容器中发生反应I和III,达到平衡状态时CH3OH( g)和CH3OCH3( g)的物质的量分别为2 mol和1 mol。则T1温度时反应I的平衡常数K=。

①B中发生的总反应的离子方程式为。
②若某废气中含有的CO2和CO的体积比为1:1,废气中CO2和CO体积分数共为13. 44%。假设A中处理了标准状况下10 m3的废气,其中CO2和CO全部转化成CH3OH ,理论上可制得C2H4Cl2 kg。
 )是齿配位体,它的配位原子为,其中 C原子的杂化方式为。
)是齿配位体,它的配位原子为,其中 C原子的杂化方式为。
①铈具有三价和四价两种价态,三价和四价间的可逆转换会造成氧空位的生成和消除。其光催化的基本原理如下图所示,当光照能量( hv )等于或大于氧化铈催化剂的能量时,氧化铈VB上的电子(e-)会受到激发跃迁至CB,留下带正电荷的空穴(h+ ) ,形成光生电子−空穴对,与所吸附的物质发生氧化还原反应。则在氧化还原反应中,空穴可视为(填“氧化剂”或“还原剂”),图中A发生(填“氧化”或“还原”)反应。

②氧化铈的晶体结构如下图所示,其中铈原子和氧原子的数量之比为,若 晶体密度为d g∙cm−3 , 阿伏加德罗常数为NA , 晶胞参数a=cm( 写出表达式)。


a.麻黄碱与盐酸、溶液均可反应
b.麻黄碱可以发生氧化、取代、加成反应
c.麻黄碱中的氮原子和所有碳原子可能共面
①苯环上有三个取代基,其中一个是;②遇到
溶液显紫色。