

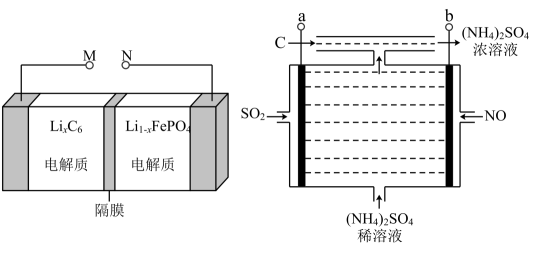

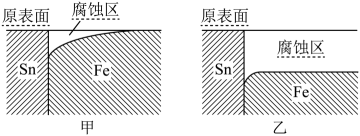

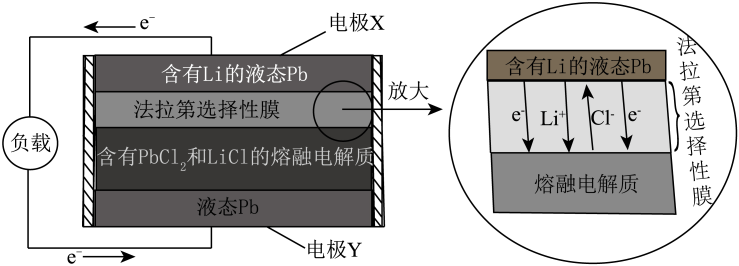
下列说法错误的是
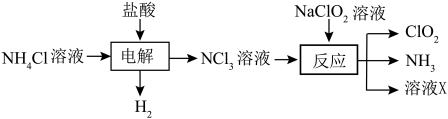
已知:①电解过程中氯元素被氧化。
②ClO2是一种黄绿色易溶于水的气体;三氯化氮为黄色油状液体,熔点较低,很不稳定,受热90℃以上或受震动时发生猛烈爆炸。下列说法正确的是





①写出PbS反应的离子方程式:。
②浸取时应控制盐酸的浓度。其他条件一定,若盐酸浓度过大,铅元素的浸出率反而下降,原因是。

过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++=2Fe3++PbSO4+2H2O
ii:2Fe3++Pb+=2Fe2++PbSO4
下列实验方案可证实上述催化过程。请将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2 , 溶液变红。
b.。

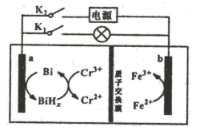
①Y极与电源(填“正极”或“负极”)相连。
②该离子交换膜为膜。
③X极的电极反应式为。
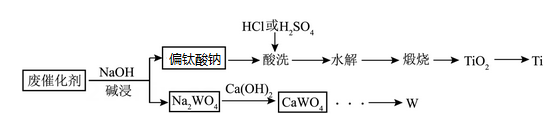
已知:①偏钛酸钠(Na2TiO3)难溶于水;“酸洗”时,Na2TiO3转化为TiOCl2或TiOSO4 , 水解后得到H2TiO3;
②当溶液中某离子浓度≤1×10-5mol/L时,认为该离子沉淀完全。
请回答下列问题:



①25℃时,和
的燃烧热
分别为akJ/mol和bkJ/mol,上述合成氨反应的焓变为kJ/mol。
②A点的温度迅速从变为
, 则此时浓度商QK(
)(填“>”“<”或“=”)。
③(
为以分压表示的平衡常数,分压=总压×物质的量分数)。
④合成氨逆反应速率方程为: , 式中k(逆)为逆反应的速率常数(只与温度有关)。从C点开始减小压强,平衡发生移动,直至达到新的平衡,v(逆)的变化过程为。

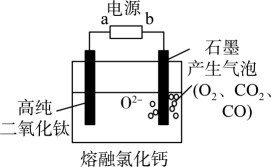
①导线中电子流动方向为。
②生成的电极反应式为。
③若惰性电极2的电流效率η为75%,则惰性电极2处与
的物质的量之比为。(
)

仪器b的名称为。
将亚铁氰化钾的饱和溶液在
以下进行电解制备铁氰化钾,其阳极上的电极反应式为。
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时,溶液的


下列说法正确的是(填字母)。
a.己二腈的分子中含有碳氮三键
b.反应②和④中均有H2O生成
c.该方法原子利用率低
电解原理如图,总反应为4CH2=CHCN+2H2O2NC(CH2)4CN+O2↑,主要副产物为丙腈(C2H5CN)。

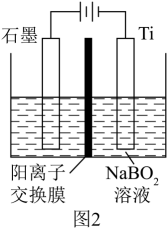
电极X为(填“阴”或“阳”)极。

则NO中氮氧键的键能是。

①曲线a对应的。
②曲线c中NO的起始浓度为 , 从A点到B点经过0.8s,该时间段内NO的脱除速率为
。
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是。

①从电解槽的(填字母)口流出。
②写出在阴极反应的电极反应式:。

回答下列问题:
①298 K时,已知相关物质的相对能量如图,则该反应的 ΔH为kJ·mol-1。

②某温度下,向某容积为1 L的恒容密闭容器中充入冒2 mol CO2和5 mol H2 , 5 min时反应达到平衡, CO2的转化率为50% ,该反应的平衡常数K为;能判断该程反应已达化学平衡状态的标志是(填标号)。
A.CO2体积分数保持不变
B.容器中混合气体的质量保持不变
C.混合气体的平均相对分子质量保持不变
D.CO2的生成速率与H2O的生成速率相等
③有利于提高体系中CO2平衡转化率的措施是(填标号)。
A.使用高效催化剂 B.增加CO2投入量
C.延长反应时间| D.及时分离CH4
(CH4的选择性=)



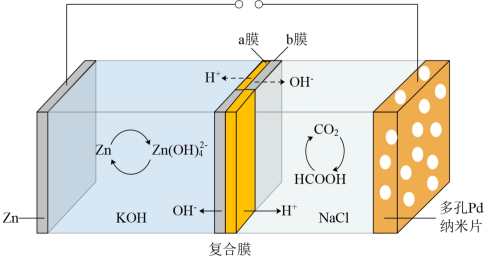
Ⅰ.我国科学家研发的水系可逆Zn-CO2电池可吸收利用CO2 , 将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的H2O解离成H+和OH- , 工作原理如图所示:
Ⅱ.科学家使CH4和CO2发生重整反应:CH4(g)+CO2(g)2CO(g)+2H2(g) △H=+247kJ•mol-1。生成合成气CO和H2 , 以实现CO2的循环利用。该反应中,如何减少积碳,是研究的热点之一。某条件下,发生主反应的同时,还发生了积碳反应:
CO岐化:2CO(g)CO2(g)+C(s) △H1=-172kJ•mol-1
CH4裂解:CH4(g)C(s)+2H2(g) △H2=+75kJ•mol-1

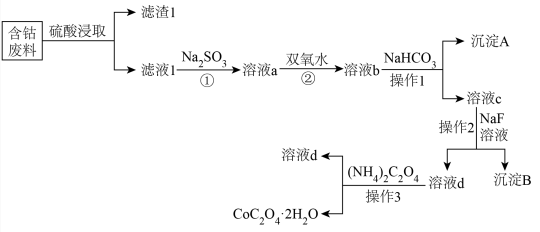


①图乙中Co电极应连接乙醇燃料电池的极(填“a”或“b”)。
②图甲中a极上发生的电极反应是。