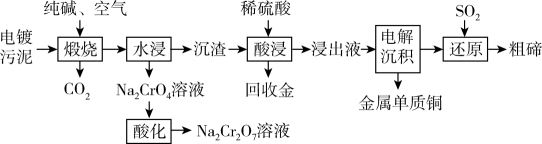
已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O22CuO+TeO2。
①已知含铬酸性废水中存在着CrO和Cr2O
相互转化的平衡,请用离子方程式表示它们之间的转化反应。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为。(写化学式)。
①氧化还原滴定过程中的离子方程式为。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中Na2Cr2O7的纯度为%。[已知M(Na2Cr2O7)=262g·mol-1 , 计算结果保留三位有效数字]
③上述实验后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。如果c(Cr3+)=3×10-5mol·L-1 , 则当溶液中开始析出Cr(OH)3沉淀时,Fe3+是否沉淀完全?(填“是”或“否”)。{已知:Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Cr(OH)3]=6.0×10-31}