

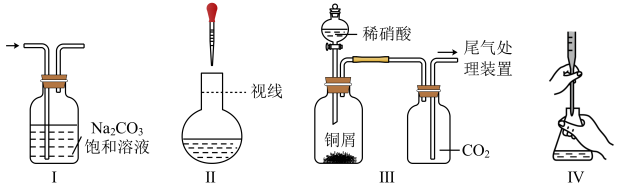


已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O22CuO+TeO2。
①已知含铬酸性废水中存在着CrO和Cr2O
相互转化的平衡,请用离子方程式表示它们之间的转化反应。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为。(写化学式)。
①氧化还原滴定过程中的离子方程式为。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中Na2Cr2O7的纯度为%。[已知M(Na2Cr2O7)=262g·mol-1 , 计算结果保留三位有效数字]
③上述实验后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。如果c(Cr3+)=3×10-5mol·L-1 , 则当溶液中开始析出Cr(OH)3沉淀时,Fe3+是否沉淀完全?(填“是”或“否”)。{已知:Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Cr(OH)3]=6.0×10-31}
已知:①实验室制备原理为。
②资料卡片:
|
物质 |
熔点/℃ |
沸点/℃ |
相对分子质量 |
其他 |
|
|
|
76.1 |
137.5 |
遇水剧烈水解,易与O2反应 |
|
POCl3 |
1.25 |
105.8 |
153.5 |
遇水剧烈水解,能溶于PCl3 |
|
SOCl2 |
|
78.8 |
119 |
遇水剧烈水解生成SO2气体和HCl气体,受热易分解 |
实验一:制备并探究SOCl2的性质,制备SOCl2的装置如图(夹持装置已略去)


①准确称量称量瓶和盖的总质量 , 迅速加入
样品,立即盖紧,称量,质量为
。
②连同称量瓶一起放入盛有溶液的密封反应瓶中,打开称量瓶瓶盖,并用蒸馏水封口,轻轻摇动,使SOCl2充分发生SOCl2+4NaOH=Na2SO3+2NaCl+2H2O反应,将反应瓶中的溶液全部转移到
容量瓶中,洗涤水解瓶2~3次,洗涤液一并转入容量瓶中,静置至室温,定容,摇匀,得到混合溶液M。
③准确量取溶液M于
锥形瓶中,先用
的盐酸中和过量的
溶液至恰好完全,后加碘标准溶液进行滴定。反应为Na2SO3+H2O+I2=Na2SO4+2HI。
④准确加入碘标准溶液,充分反应后,用淀粉溶液作指示剂,用
的
溶液滴定过量的碘,反应为
。平行测定两次,反应消耗
溶液的平均体积为
。
I.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.3kJ·mol-1
Ⅱ.2CO(g)+4H2(g) C2H4(g)+2H2O(g) ΔH=+210.5kJ·mol-1
CO2加氢合成乙烯的热化学方程式为。
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=—48.5kJ·mol-1
Ⅱ.2CO2(g)+5H2(g) C2H2(g)+4H2O(g) ΔH=+37.1kJ·mol-1
在压强为P,CO2、H2的起始投料为1:3的条件下,发生反应I、Ⅱ,实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度的变化如图所示:

已知:CH3OH的选择性=
①有利于提高CH3OH的选择性的措施有(填序号)。
A.适当降温 B.适当升温 C.选择合适的催化剂
②温度高于350℃时,体系中发生的反应以(填“I”或“Ⅱ”)为主,并说明理由。
③其中表示平衡时CH3OH的选择性的曲线是填“a”或“b”)。
④400℃时,在该压强及投料比的条件下,利用图示所给数据计算H2的转化率为(保留三位有效数字)。

已知:无水醋酸钠与碱石灰混合共热制甲烷:CH3COONa+NaOH CH4+Na2CO3

请结合相关信息回答下列问题:
E→F:,反应类型:;
C+F→G:,反应类型:。